Целью проведения опыта являлось экспериментальное воспроизведение актиномикоза у лабораторных животных на примере белых мышей и кроликов; проследить за развитием актиномиком в их организме и выделить чистую культуру возбудителя.
В опыте использовали двух-, трёхнедельных белых мышей живой массой 20 – 25 г. и кроликов в возрасте одного месяца.
Белых мышей заражали внутрибрюшинно путём введения суспензии в дозе 0,2 – 0,4 мл3. [ ] Для приготовления суспензии использовали содержимое актиномикозного узла (гной), полученное при вскрытии животного, больного актиномикозом. Имеющийся материал растирали в ступке с физиологическим раствором, в соотношении 1:5 с последующим добавлением пенициллина из расчёта 1000 МЕ на 1мл3. раствора [ ]. Внутрибрюшинное заражение двух-, трёхнедельных мышей в количестве 6 голов проводили трёхкратно с интервалами в 7 дней. Контрольным животным по этой же схеме вводили стерильный физраствор. Подопытных и контрольных вынуждено убитых белых мышей исследовали через 10 дней после каждого введения суспензии.
При первом введении суспензии в дозе – 0,2 мл3. мышатам №1 и №2, убитых через 10 дней после первого заражения видимых патологоанатомических изменений обнаружить не удалось. Повторная инокуляция суспензии мышам №3 и №4 в дозе – 0,2 мл3. и при дальнейшем их убое через 10 дней после введения, у мыши №3 было отмечено увеличение печени, которая была глинистого цвета, с утолщенными краями, мягкой консистенции. Какие-либо других изменения этого органа отсутствовали.
При третьем введении суспензии мышатам №5 и №6 инокулированную дозу увеличили в два раза. В результате через 10 дней после заражения были обнаружены округлые, единичные серо-жёлтые, бело-жёлтые образования, диаметром 3 – 4 мм., с гнойным размягчением в центре. Кроме того, отмечалось серозное воспаление брюшины [ ].

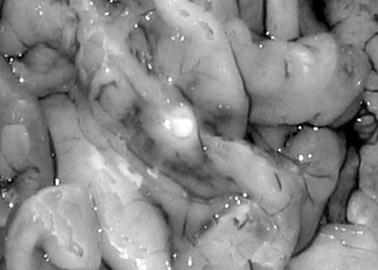
 Так, у мыши №5 округлое образование (узелок) было расположено в области селезёнки (рисунок. 2).У мыши №6 узелок располагался на брыжейке (рисунок 3).
Так, у мыши №5 округлое образование (узелок) было расположено в области селезёнки (рисунок. 2).У мыши №6 узелок располагался на брыжейке (рисунок 3).

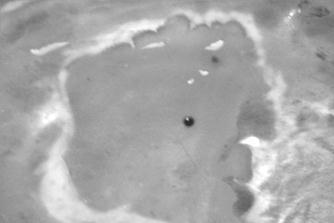
 В дальнейшем от этих мышей было отобрано содержимое узелков и высеяно на агар Сабуро [ ]. На 20 день после посева на агаре выросли культуры актиномицетов (рисунок 4 и рисунок 5).
В дальнейшем от этих мышей было отобрано содержимое узелков и высеяно на агар Сабуро [ ]. На 20 день после посева на агаре выросли культуры актиномицетов (рисунок 4 и рисунок 5).
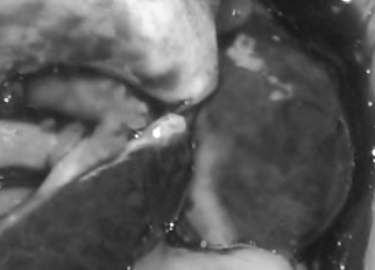 |
Рисунок 2 рисунок 3
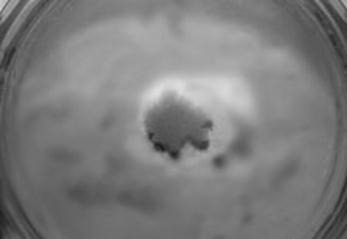 Рисунок 4 рисунок 5
Рисунок 4 рисунок 5
Из числа 12 кроликов — 6 заразили внутрибрюшинно и 6 — внутримышечно. При внутримышечном заражении культуру A. bovis в объеме 0,5 мл3 (1,25 млрд., микробных тел) вводили два раза, с интервалом в 5 суток, в мышцу бедра. Через 15 – 21 день после заражения актиномикомы у кроликов достигали величины лесного ореха. Средний вес актиномиком колебался от 1,5 до 3,0 г и содержали до 2 мл3 гнойного экссудата.
Внутрибрюшинное заражение одномесячных кроликов в количестве 6 голов проводили двукратно с интервалами в 5 дней. Культуры для инокуляции готовились так же, как и при внутримышечном заражении кроликов, причем вводимая доза была равна 1 мл3 — 2,5 млрд. микробных тел по оптическому стандарту. Убой кроликов проводили через 12 — 30 -60 дней после заражения.
На вскрытии кролика №1, убитого через 12 дней после первого и 7 дней после повторного заражения, обнаружили 7 актиномикозных очагов величиной с маковое зерно в области печени, брыжейки, брюшины. У кролика № 2 было обнаружено два очага на печени, один очаг на брюшине и один брыжейке. При высеве патологического материала от обоих кроликов были получены ретрокультуры анаэробных штаммов актиномицетов. При забое кролика №3 очагов поражения не наблюдали.
В результате эксперимента была установлена возможность экспериментального воспроизведения актиномикоза у подопытных белых мышей и кроликов, а также выделена чистая культура возбудителя заболевания, при отрицательном контроле.