Известно, что периферическое депо НА, осуществляющего нейромедиаторную функцию, играет важную роль в регуляции болевой чувствительности (Брагин, 1991). Для выявления роли НА-ергической системы в механизме антиноцицептивного действия ЭМИ КВЧ при экспериментально вызванной тонической боли была проведена серия исследований (рис. 8.1), в которой экспериментальных животных разделили на шесть равноценных групп по пять особей в каждой. Всех животных подвергали воздействию болевого стресса в «формалиновом тесте». У животных 3-ей (Пβ+ФТ) и 4-ой (Пβ+КВЧ+ФТ) групп за 1 час до болевого теста блокировали β-адренергические рецепторы путем внутрибрюшинного введения растворенного в физиологическом растворе пропранолола (ООО «Фармакологическая компания «Здоровье», Украина). Данный неселективный β-адреноблокатор характеризуется низкой биодоступностью (количество активного вещества, которое всасывается из места введения из лекарственной формы, достигая системного кровотока, откуда оно поступит к месту действия и даст свой эффект) всего 10–30% (Kirch W. et al., 1987), периодом полувыведения 3-5 часов (Штрыголь, 1995). Данный препарат вводился из расчета 5 мг на 1 кг веса животного (Брагин, 1991). У крыс 5-ой (Нα+ФТ) и 6-ой (Нα+КВЧ+ФТ) групп путем внутрибрюшинной инъекции раствора ницерголина («Pharmacia», Италия), синтетического производного алкалоидов спорыньи, с присоединенным бромзамещенным остатком никотиновой кислоты, имеющего период полураспада около 8 часов (Логановский, Юрьев, 2005) вызывали блокирование α-адренергических рецепторов. Препарат вводили внутрибрюшинно из расчета 1,25 мг на 1 кг веса животного за 1 час до инъекции формалина. Крысам 1-ой (ФТ) и 2-ой (КВЧ+ФТ) групп внутрибрюшинно вводили эквивалентный объем физиологического раствора (0,9 % раствор NaCl). Непосредственно перед болевым тестом крыс 2-ой (КВЧ+ФТ), 4-ой (Пβ+КВЧ+ФТ) и 6-ой (Нα+КВЧ+ФТ) групп подвергали воздействию ЭМИ КВЧ в течение 30 минут на затылочно-воротниковую область.
Результаты исследования показали, что у крыс третьей группы (Пβ+ФТ) при введении пропранолола – неселективного β-адреноблокатора, отмечалась тенденция к уменьшению продолжительности болевой реакции на 7,03 % (p>0,05) относительно значений этого показателя у животных контрольной группы, подвергнутых изолированной инъекции формалина (табл. 7.4; рис. 7.15). При этом отмечалось достоверное увеличение длительности двигательной активности у животных данной группы на 81,34 % (p<0,001) (увеличилась продолжительность реакций груминга и приема пищи в 1,79 раза (p<0,001) и 96,55 раза (p<0,001) соответственно) по сравнению со значениями у животных контрольной группы (ФТ) (табл. 7.5; рис. 7.15).
Таким образом, введение пропранолола – блокатора β-адренергических рецепторов не влияло на болевую чувствительность у животных, что подтверждает исследования других авторов (Калюжный, 1981; Брагин, 1991).
Предварительное блокирование β-адренорецепторов с помощью пропранолола на фоне воздействия ЭМИ КВЧ у животных четвертой группы (Пβ+КВЧ+ФТ) вызвало изменение продолжительностей как болевых, так и неболевых поведенческих реакций в ФТ. Так, общая продолжительность болевой реакции имела лишь тенденцию к повышению (на 4,51 %; p>0,05) относительно значений у животных второй группы (КВЧ+ФТ), подвергнутых КВЧ-воздействию без введения препарата. Однако продолжительность первой острой фазы болевой реакции увеличилась на 211,65 % (p<0,001), а второй тонической, напротив, уменьшилась на 18,31 % (p<0,05) относительно значений данных показателей у крыс второй группы (КВЧ+ФТ) (табл. 7.5; рис. 7.15).
По сравнению же со значениями у животных первой группы (ФТ), подвергавшихся изолированному действию болевого фактора у крыс четвертой группы (Пβ+КВЧ+ФТ) продолжительность болевой реакции уменьшилась на 48,16 (p<0,01) (первой острой фазы – на 11,21 %; p>0,05, а второй тонической – 55,27 %; p<0,01) (табл. 7.5; рис. 7.15).
Таблица 7.5.
Общая продолжительность (с) болевой и неболевых поведенческих реакций у крыс в «формалиновом тесте» (ФТ) на фоне предварительной инъекции блокатора β-адренорецепторов– пропранолола (Пβ+ФТ), воздействия электромагнитного излучения крайне высокой частоты (КВЧ+ФТ) и их комбинированного действия (Пβ+КВЧ+ФТ) (![]() )
)
| Тип поведенческой реакции | Экспериментальные группы воздействия | |||
| ФТ(1) | КВЧ+ФТ(2) | Пβ+ФТ(3) | Пβ+КВЧ+ФТ(4) | |
| Болевая реакцияВ том числе: | 902,83±20,02 | 447,80±19,35Р1,2<0,001
Р2,3<0,001 |
839,33±35,48 р2,3<0,001 р3,4<0,01 | 468,00±13,23 р1,4<0,001Р3,4<0,01 |
| 1 фаза | 145,67±7,53 | 41,50±4,57 р1,2<0,001 р2,3<0,01Р2,4<0,01 | 149,67±8,69 р2,3<0,01 | 129,33±5,49 р2,4<0,01 |
| 2 фаза | 757,17±23,46 | 414,60±13,43 р1,2<0,001Р2,3<0,05 | 689,67±33,23Р2,3<0,05
Р3,4<0,01 |
338,67±7,86Р1,4<0,01
Р3,4<0,01 |
| Бег | 136,83±10,07 | 371,40±5,61 р1,2<0,001 р2,3<0,001 р2,4<0,001 | 146,67±11,46 р2,3<0,001 | 202,33±11,35 р1,4<0,05Р2,4<0,001 |
| Груминг | 34,67±4,55 | 196,60±15,55 р1,2<0,001 р2,3<0,001 р2,4<0,001 | 62,00±7,64 р1,3<0,02 р2,3<0,001 р3,4<0,02 | 38,33±2,03 р2,4<0,001Р3,4<0,02 |
| Прием пищи | 1,83±0,60 | 26,20±4,25 р1,2<0,001 р2,3<0,001 р2,4<0,001 | 177,00±13,58 р1,3<0,001 р2,3<0,001 | 190,33±26,59 р1,4<0,001 р2,4<0,001 |
| Покой | 2523,83±24,26 | 2543,00±21,96 | 2375,00±42,45 | 2701,00±49,11 |
Примечание: р1-4 – различия достоверны между группами, обозначенными в таблице 1-4 соответственно по критерию Стьюдента.
При этом длительность двигательной активности у животных этой группы уменьшилась на 27,23 % (p<0,01) относительно значений этого показателя у крыс, подвергавшихся воздействию ЭМИ КВЧ и болевого стресса, но увеличились на 148,65 % (p<0,001) относительно значений данных показателей у крыс первой группы (ФТ) (табл. 7.5; рис. 7.15).
|
|
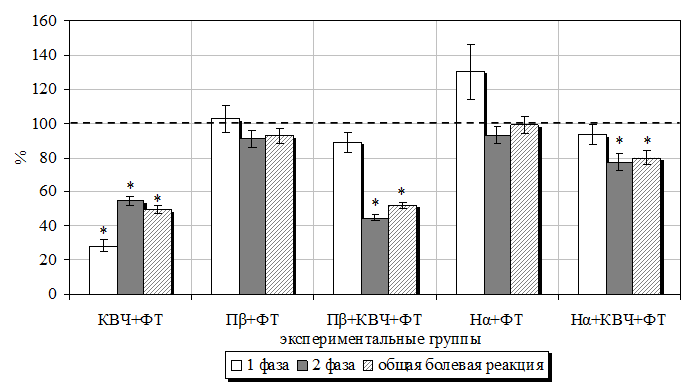
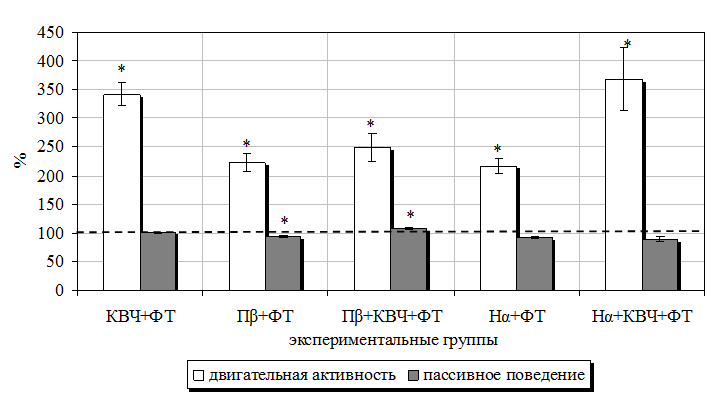
Рис. 7.15. Изменение продолжительности болевой (первой острой и второй тонической фаз) (А) и неболевых (двигательной активности и пассивного поведения) (Б) поведенческих реакций у крыс в «формалиновом тесте» (ФТ) на фоне предварительного воздействия электромагнитного излучения крайне высокой частоты (КВЧ), введения блокатора α-адренорецепторов ницерголина (Нα), блокатора β-адренорецепторов пропранолола (Пβ) (в % относительно значений у животных, подвергнутых изолированному действию болевого фактора, принятого за 100 %)
Примечание *– достоверность различий по критерию Стьюдента относительно значений у животных, подвергнутых изолированному действию болевого фактора.
Таким образом, блокада β-адренорецепторов не вызвала снижения аналгетического эффекта низкоинтенсивного ЭМИ КВЧ относительно общей продолжительности болевой реакции и ее тонического компонента. Уменьшение аналгетической эффективности КВЧ-воздействия на 60,30 % при введении пропранолола регистрировалось только в первой острой фазе болевого стресса.
У животных пятой группы, которым перед ФТ дополнительно вводили α-адреноблокатор ницерголин общая продолжительность болевой реакции не изменилась на фоне увеличения продолжительности первой фазы (на 30,21 %; p<0,05) и тенденции к уменьшению второй фазы болевого стресса (ФТ). Длительность двигательной активности повысилась на 115,96 % (p<0,001), а пассивного поведения, напротив, имела тенденцию к уменьшению (на 7,63 %; p>0,05) по сравнению с данными у животных первой группы, подвергнутых изолированной инъекции формалина. Следовательно, блокирование α-адренорецепторов также не вызывало изменения болевой чувствительности у животных (табл. 7.6; рис. 7.15).
При КВЧ-воздействии на фоне введения ницерголина у животных шестой группы (Нα+КВЧ+ФТ) в ФТ произошло увеличение продолжительности болевой реакции на 61,01 % (p<0,001) (первой фазы – на 227,71 % (p<0,001), второй – на 41,10 % (p<0,001)) относительно значений данных показателей у крыс, подвергавшихся только предварительному воздействию ЭМИ КВЧ. При этом продолжительность болевой реакции приближалась к таковой у животных, подвергнутых изолированному болевому стрессу (табл. 7.6; рис. 7.15). По сравнению со значениями у животных первой группы, подвергнутых изолированной инъекции формалина продолжительность болевой реакции у животных шестой группы (Нα+КВЧ+ФТ) уменьшилась на 20,14 % (p<0,001) (первой фазы – на 6,64 % (p>0,05), второй – на 22,74 % (p<0,05)).
Продолжительности неболевых поведенческих реакций не изменились относительно значений у животных, дополнительно подвергнутых только воздействию ЭИМ КВЧ без введения препарата. Но относительно значений данного показателя у крыс первой группы (ФТ) длительность двигательной активности увеличилась на 268,27 % (p<0,001), а пассивного поведения, напротив, уменьшилась на 11,22 % (p<0,001) (табл. 7.6; рис. 7.15).
Таблица 7.6.
Общая продолжительность (с) болевой и неболевых поведенческих реакций у крыс в «формалиновом тесте» (ФТ) на фоне предварительной инъекции блокатора α-адренорецепторов ницерголина (НαС+ФТ), воздействия электромагнитного излучения крайне высокой частоты (КВЧ+ФТ) и их комбинированного действия (Нα+КВЧ+ФТ) (![]() )
)
| Тип поведенческой реакции | Экспериментальные группы воздействия | |||
| ФТ(1) | КВЧ+ФТ(2) | Нα+ФТ(3) | Нα +КВЧ+ФТ(4) | |
| Болевая реакцияВ том числе: | 902,83±20,02 | 447,80±19,35Р1,2<0,001
Р2,3<0,001 |
894,33±41,25 р2,3<0,001 р2,4<0,001Р3,4<0,02 | 721,00±32,15Р1,4<0,001
Р2,4<0,001 Р3,4<0,02 |
| 1 фаза | 145,67±7,53 | 41,50±4,57 р1,2<0,001 р2,3<0,001 | 189,67±20,99 р2,3<0,001 р2,4<0,001 р3,4<0,05 | 136,00±4,62 р2,4<0,001Р3,4<0,05 |
| 2 фаза | 757,17±23,46 | 414,60±13,43 р1,2<0,001Р2,3<0,001 | 704,67±28,82 р2,3<0,001 р2,4<0,001 р3,4<0,05 | 585,00±34,08Р1,4<0,05
Р2,4<0,001 р3,4<0,05 |
| Бег | 136,83±10,07 | 371,40±5,61 р1,2<0,001 р2,3<0,001 | 260,33±17,57 р1,2<0,001 р2,3<0,001 | 337,00±83,07 р1,4<0,01 |
| Груминг | 34,67±4,55 | 196,60±15,55 р1,2<0,001 р2,3<0,001 | 52,33±6,69 р2,3<0,001 р2,4<0,05 р3,4<0,001 | 127,33±4,10 р1,4<0,001Р2,4<0,05
Р3,4<0,001 |
| Прием пищи | 1,83±0,60 | 26,20±4,25 р1,2<0,001 р2,3<0,01 | 61,67±7,84 р1,2<0,001Р2,3<0,01 р2,4<0,001 р3,4<0,001 | 174,00±12,70 р1,4<0,001Р2,4<0,001 р3,4<0,001 |
| Покой | 2523,83±24,26 | 2543,00±21,96 р2,3<0,01 | 2331,33±50,99 р1,2<0,01 р2,3<0,01 р2,4<0,05 | 2240,67±119,85 р1,4<0,02Р2,4<0,05 |
Примечание: р1-4 – различия достоверны между группами, обозначенными в таблице 1-4 соответственно по критерию Стьюдента.
Таким образом, введение ницерголина вызвало значительное уменьшение аналгетического эффекта ЭМИ КВЧ на 30,26 % (p<0,001), особенно проявившийся в первой острой фазе болевой реакции, что является доказательством участия α-адренергических рецепторов в механизмах антиноцицептивного действия ЭМИ КВЧ.
Полученные результаты свидетельствуют о том, что выключение норадренергической системы не влияет на фоновую болевую чувствительность крыс. Это может быть объяснено тем, что «мощность» сохранившихся, т. е. незаблокированных норадренергических нейронов в связи с низкой биодоступностью препарата достаточна для обеспечения механизмов регуляции болевой чувствительности (Брагин, 1991). Однако участие НА-ергической системы (особенно α-адренорецепторов) в механизмах антиноцицептивного действия низкоинтенсивного ЭМИ КВЧ очевидно.
Автор — Джелдубаева Эльвиза Рашидовна