 |
План.
I Введение.
II Основная часть.
История исследования плазмид.
Идентификация плазмид.
Классификация плазмид.
Поверхностное исключение и летальный зигозис.
Несовместимость и группы несовместимости.
Молекулярная и генетическая организация плазмид.
Молекулярная организация плазмид.
Генетическая организация факторов переноса.
Генетическая организация конъюгативных плазмид.
Генетическая организация неконъюгативных плазмид.
Поддержание в клетках.
Репликация.
Распределение между клетками.
Генетическая регуляция.
Конъюгационный перенос.
Свойства бактерий, контролируемые плазмидами.
Плазмиды лекарственной устойчивости.
Общая характеристика и механизмы действия.
Мутации внехромосомных детерминантов резистентности.
Элиминация R-плазмид.
Лекарственная конверсия.
Продление чувствительности к лекарствам.
Плазмиды бактериоциногении.
Плазмиды и патогенность бактерий.
Атрибуты патогенности.
Плазмиды и патогенность E. coli.
Плазмиды и патогенность других бактерий.
III Заключение.
IV Список использовавшейся литературы.
Плазмиды – внехромосомные генетические элементы,
Способные к автономному поддержанию в цитоплазме бактерий или существованию в интегрированном в хромосому состоянии, откуда они могут свободно выходить в цитоплазму (иногда с фрагментами хромосомы). Некоторые хромосомы могут распространяться в бактериальной популяции между ее членами. Плазмиды определяют ряд важных свойств бактерий:
Являются факторами фертильности – определяют донорский фенотип клетки.
Контролируют резистентность к антибиотикам, сульфаниламидам, катионам тяжелых металлов, бактериоцинам, бактериофагам, к сыворотке крови.
Чувствительность к бактериоцинам
Синтез тиамина, пролина, внеклеточной ДНКазы и др.
Синтез антибиотиков и бактериоцинов.
Метаболизм углеводов, углеводсодержащих соединений, галогеновых соединений, белков.
Фиксацию азота.
Продукцию токсинов, гемолизина, антигенов колонизации, капсулы.
В последнее время природа факторов внехромосомной наследственности
Микроорганизмов приобрела особый интерес в связи с появлением данных о возможности использования плазмид в качестве векторов эукариотных генов. Такая возможность открывает неограниченные перспективы для генетического моделирования не только при решении проблем молекулярной биологии, но и в практическом аспекте, в частности в медицинской микробиологии и иммунологии (создание новых бактерийных профилактических и лечебных препаратов) и микробиологической промышленности.
Большой опыт экспериментального мутагенеза на модели бактерий и вирусов способствовал раскрытию генетических и молекулярных механизмов регуляции функций внехромосомных элементов. Их способность включаться в хромосому и формировать комплексы «замещенных» плазмид широко используется в экспериментальной биологии и генетике. Замещенные плазмиды несут фрагменты хромосомы бактерии-хозяина и в автономном состоянии функционируют под контролем регуляторных механизмов бактериальной клетки. Расширение методических и технических возможностей экспериментальных исследований в области молекулярной биологии позволяет целенаправленно использовать генетические модели в решении важных практических задач.
Определились реальные пути более гибкого вмешательства в процессы физиологически нормального генетического обмена у бактерий, осуществляемого с участием внехромосомных элементов, способствующих конъюгации, формированию рекомбинантов, передаче генетического материала путем трансдукции умеренными фагами, мобилизации нетрансмиссивных элементов плазмидами, имеющими в своей структуре «гены трансмиссивности», и сочетания с этими генами фрагментов хромосомы с последующим переносом вновь формирующихся структур и их ассоциаций в клетки реципиентов. Актуальное значение приобретает исследование механизмов взаимодействия внехромосомных элементов с хромосомой и между собой в естественных или сконструированных искусственно полиплазмидных системах. Подчинение этих систем общим регуляторным механизмам на уровне клетки и популяции микроорганизмов выдвигает новые проблемы: изучение специфических особенностей полиплазмидных популяций при наличии дополнительных генетических факторов, не обязательных для воспроизведения жизнеспособного потомства, и возможностей практического использования искусственно обогащенного генома популяций бактерий.
В последнее десятилетие интенсивно накапливаются данные о генетической природе и биологических особенностях плазмид, с которыми непосредственно связана патологическая активность бактерий. Это – элементы Hly, Ent, Vir, сведения о которых в мало обобщены. Практическое значение в инфекционной патологии приобретают «вторичные» процессы при ожоговых заболеваниях и постхирургических осложнениях, возникающих в связи с неограниченно возрастающей множественностнной лекарственной устойчивостью возбудителей этих процессов, контролируемой трансмиссивными и нетрансмиссивными факторами инфекционной резистентности. Менее полно изучены, но не менее важны плазмиды, контролирующие патогенные свойства стафилококков, стрептококков, псевдомонад.
В настоящее время на основе использования трансмиссивных эписом интенсивно разрабатывается новое направление исследований — «генетическая инженерия» и как
Специальный раздел этого направления — «генная инженерия». Последняя представляет собой область прикладной молекулярной генетики и биологии, развитие которой только начинается. Однако первоисточником «сырья» для осуществления конкретных задач конструирования новых биологически активных молекул являются внехромосомные элементы, способные функционировать в виде самостоятельных оперонов и репликонов. Они сохраняют эту функцию в гетерологичных системах микроорганизмов и, что особенно привлекает «биоинженеров», — в системах эукариотов.
История исследования плазмид.
Начало исследования плазмид относят к 20 гг. XX века. В 1921 г. Bourdet и Ciuca открыли лизогенные бактерии, способные спонтанно лизироваться. В 1925 г. Gratia обнаружил фактор, подавлявший рост некоторых видов энтеробактерий – «принцип V». Wollman в 1928 г. высказал предположение о трансмиссивности факторов лизогенности. В 1932 г. Gratia идентифицировал обнаруженный им фактор, обладавший антагонистической активностью как белковоподобное вещество. Это исследование дало начало изучению колициногенности – способности бактерий E. Coli продуцировать колицины – вещества, подавляющие рост близкородственных бактерий.
![]() Основываясь на сходстве выражения бактериоциногенности и лизогенности бактерий, Fredericq (1946) высказал гипотезу об идентичности продуктов летального синтеза, определяющих названные свойства. Согласно его концепции, детерминанты синтеза колицинов представляют собой дефектный бактериофаг, сохранивший способность летального синтеза, но утративший гены, ответственные за формирование фаговых частиц.
Основываясь на сходстве выражения бактериоциногенности и лизогенности бактерий, Fredericq (1946) высказал гипотезу об идентичности продуктов летального синтеза, определяющих названные свойства. Согласно его концепции, детерминанты синтеза колицинов представляют собой дефектный бактериофаг, сохранивший способность летального синтеза, но утративший гены, ответственные за формирование фаговых частиц.
В 1946 г. Д. Ледерберг и Э. Татум использовали смешанное культивирование ауксотрофных мутантов E. Coli K12 и открыли конъюгацию бактерий. В дальнейшем было доказано, что при конъюгации часть клеток являются донорами, а часть реципиентами, что зависит от присутствия внехромосомного фактора фертильности: F-фактора, откуда следовал вывод об односторонности механизма и наличия F+ и F — фенотипов. Дальнейшие исследования показали возможность превращения клеток F — в F+ в смесях клеток обоих типов, что указывало на трансмиссивность F-фактора. Было также доказано существование внехромосомных элементов – «плазмид». Как оказалось позднее, плазмида (фактор) F является чистым фактором генетического переноса, так как обладает лишь генами переноса и генами репликации.
Внехромосомная природа фактора F была доказана на основании результатов обработки бактерий F+ акридиновыми красителями, что приводит к «удалению» фактора F из клеток популяции и превращает их из доноров в реципиентов (Hirota, Jidjima, 1956; Lederberg, 1958; Wollman, Jacob, 1956).
Работы 50-х годов показали, что плазмида F может находиться как автономном состоянии (в цитоплазме), так и в интегрированном в хромосому.
В 1952 г. Lwoff систематизировал материалы по лизогении и впервые предложил термин «плазмиды» для обозначения «внехромосомных симбиотических организмов». В настоящее время этот термин рекомендуется в качестве основного для определения внехромосомных факторов наследственности у бактерий.
В начале 60-х гг. была установлена возможность выхода плазмиды из хромосомы в цитоплазму. При этом иногда захватываются гены хромосомы.
Fredericq (1963) показал связь колициногенных факторов с факторами «половой полярности» бактерий и привел экспериментальные доказательства возможности рекомбинаций между внехромосомными элементами и фрагментами хромосомы бактерии хозяина.
Открытие во второй половине 50-х годов японскими исследователями генетических элементов, контролирующих множественную трансмиссивную устойчивость бактерий к наиболее широко применявшимся антибиотикам и синтетическим химиотерапевтическим препаратам сульфаниламидного ряда, ознаменовало новый этап в изучении внехромосомных факторов наследственности бактерий (Watanabe, 1963; Mitsuchashi, 1960, и др.). Она передавалась в результате клеточных контактов, независимо от переноса бактериальной хромосомы. Для обозначения детерминантов лекарственной резистентности Mitsuhashi S. предложил символ R. Многочисленные исследования в 60 -70-е гг. показали, что R-плазмиды присутствуют в бактериях многих видов, широко распространены географически, отличаются друг от друга и по генетическому составу и по фенотипическим проявлениям.
В середине 60-х годов английские исследователи (Datta, 1965; Anderson, 1965; Datta, Meynell, 1965) представили данные о природе фактора трансмиссивности—RTF, и его аналога—фактора А, способных существовать в свободном состоянии и формировать комплексы с детерминантами резистентности к отдельным антибиотикам, не обладающим собственными генами трансмиссивности. Эти исследователи установили функциональную гомологию «секс-фактора» и фактора передачи резистентности к антибиотикам, а также показали филогенетические связи плазмид резистентности с другими трансмиссивными плазмидами.
Важное значение для понимания механизмов передачи внехромосомных элементов имели исследования поверхностных структур у бактерий, опосредующих конъюгационную передачу генетического материала (Brinton, 1965; Meynell, Lawn, 1967). Эти работы явились основой для дифференцированного подхода к оценке роли «ворсинок» разного типа в определении групп совместимости (или несовместимости) факторов резистентности и других внехромосомных элементов. В 1967 г. Smith и соавторы открыли внехромосомные элементы, непосредственно контролирующие формирование патогенных свойств у энтеробактерий, выделенных от животных и человека. Был выявлен трансмиссивный Детерминант гемолитической активности – фактор Н1у в штаммах E. coli животного происхождения (Smith, Halls, 1967).
В той же лаборатории обнаружен самостоятельный внехромосомный элемент, контролирующий синтез энтеротоксина — плазмида Ent (Smith, Linggood, 1971).
Д. Г. Кудлай и соавт. (1969) выявили трансмиссивный элемент Н1у, контролирующий синтез гемолизинов типа р и токсических веществ, вызывающих дермонекрозы и гибель лабораторных животных, у штаммов E. coli, выделенных от человека при токсической диспепсии.
В 70-е гг. появляются сведения о детерминированной резистентности к тяжелым металлам, о контроле плазмидами метаболизма липополисахаридов и других компонентов клеточной стенки бактерий, синтеза токсинов, бактериоцинов, синтеза различных ферментов. В 80-е гг. были открыты полиплазмидные системы переноса плазмид.
В России исследования плазмид были начаты в конце 50-х гг. в лабораториях Д. Г. Кудлай и А. П. Пехова.
Идентификация плазмид.
Идентификация на генетическом уровне.
Этот метод идентификации основан на учете фенотипов исследуемых бактерий (свежих изолятов) по сравнению с фенотипами известных штаммов, а так же на последующем установлении трансферабельности интересующего свойства к другим бактериям.
Что бы проверить, детерминируется ли отличающий признак плазмидой, прибегают к конъюгационным скрещиваниям резистентных клеток (доноры) с чувствительными клетками (акцепторы). Положительный результат в форме наблюдения конъюгации и селекции резистентных трансконъюгантов означает, что лекарственная устойчивость в исследуемом случае трансмиссивная.
При получении отрицательных результатов, сначала делают предположение, что признак контролируется неконъюгативной плазмидой. В этом случае пытаются провести мобилизацию на перенос исследуемую плазмиду известной конъюгативной плазмидой.
Если и этот тест не дал положительных результатов, то предполагают, что возможно, по каким-то причинам, плазмида оказалась недоступной для мобилизации. Вопрос о плазмидной резистентности в данном случае решают в зависимости от результатов экспериментов по трансдукции.
Установление плазмидной резистентности должно сопровождаться исключением резистентности, контролируемой транспозируемыми генетическими элементами (транспозонами).
В тех случаях, когда исследуемый признак легко обнаруживается при изучении отдельных колоний, дополнительную информацию может дать изучение стабильности плазмид. При этом исследуют как спонтанную элиминацию плазмид (следствие ошибок репликации или распределения между дочерними клетками плазмидных копий, что с трудом поддается математическому учету), так и индуцированную. К индуцированной элиминации прибегают тогда, когда спонтанная элиминация происходит с чрезвычайно низкой частотой. Обычно используют акридин оранжевый или этидий бромид. Универсального элиминационного химического агента к настоящему времени не найдено, поэтому обычно прибегают к комбинированной обработке различными химическими веществами.
Если резистентность детерминируется хромосомно, то мутация, сопровождающаяся утерей признака, может ошибочно указать на плазмидный контроль признака. В этом случае прибегают к индукции обратных мутаций, что позволит исключить ложное предположение.
Для идентификации F-подобных факторов генетического переноса прибегают к использованию реакции нарастания титра F-дононорспецифических фагов (РНТФ) в культурах исследуемы бактерий, которые не имеют видимых свойств, указывающих на содержание в них плазмид. Положительная РНТФ указывает на присутствие в клетках фактора переноса.
Значительно сложнее осуществлять идентификацию и определение типовой принадлежности плазмид в бактериальной клетке, которые могут содержать комплексы плазмид, состоящие из нескольких плазмид разных типов, включая F-факторы. В таких случаях прибегают к «разгонке» плазмид с помощью скрещиваний или физических методов с последующей генетической характеристикой каждой плазмиды.
Идентификация на молекулярном уровне.
Идентификация плазмид в этом случае производится путем выделения, очистки и характеристики плазмидной ДНК, количество которой в плазмидосодержащих клетках составляет около 5% тотальной ДНК клетки.
Основная сложность в выделении ДНК плазмид – отделение от хромосомной ДНК.
Это достигается с помощью ультрацентрифугирования в градиенте плотности хлористого цезия.
В исследованиях используют метод электрофореза, с помощью ферментов-рестриктаз получают физические карты плазмид. Молекулярная масса ДНК плазмиды определяется с помощью определения контурной длины молекулы используя электронную микроскопию.
Распространение плазмид.
Плазмиды в диких бактериальных популяциях распространены очень широко и их можно выявить у бактерий по всей планете.
Плазмиды выявляются во многих видах грамотрицательных анаэробов и аэробов, неспоровых анаэробов, кокков, коккобацилл, грамположительных неспоровых палочковых форм и кокков, споровых палочек и кокков, актиномицетов и родственных форм, микоплазм, спирилл, миксококков, фототрофов, цианобактерий, одноклеточных водорослей, дрожжей, трипаносом и т. д.
Классификация плазмид.
В 50-е гг. плазмиды R стали классифицировать на fi+ и fi- (по способности ингибировать перенос плазмиды F). Далее стали, в зависимости от различия в пилях, выделять F и I-подобные плазмиды.
Современные подходы к классификации плазмид основаны на комплексном учете их генетических свойств.
Еще в ранних работах по изучению плазмид было замечено, что существуют факторы, препятствующие конъюгационному переносу плазмид от доноров к реципиентам, содержащим одинаковые и сходные плазмиды. Один из таких факторов – поверхностное исключение: в скрещиваниях плазмида не переходит из клеток доноров в клетки реципиенты, содержащие сходную плазмиду. В результате поверхностного исключения перенос снижается в 10-400 раз по сравнению с нормой. Следующий фактор был открыт в 60-е гг. – летальный зигозиз. Смешивание клеток доноров с клетками реципиентами, добавленными в смесь в значительно меньшем количестве, чем клетки доноры, сопровождается снижением числа жизнеспособных зигот, наследующих донорский генетический материал. Наконец результативность переноса зависит от несовместимости плазмид. В наиболее простом виде несовместимость заключается в том, что при переносе одна из плазмид элиминируется. Если в клетке обе плазмиды сохраняются, то это указывает на их совместимость. Обычно несовместимы те плазмиды, контроль репликации которых одинаков.
Поверхностное исключение и летальный зигозиз.
Поверхностное исключение (sfx) лучше всего исследовано в случае F-плазмид. Экспериментальные данные свидетельствуют, что это свойство плазмид F детерминируется генами tra S и tra T. Мутации этих генов снижают sfx в 15-20 раз. Изучение роли белка tra T плазмид F показало, что этот белок либо снижает частоту формирования стойких клеточных агрегатов в процессе скрещивания клеток, либо связан с концом f-пили, предупреждая взаимодействие последней с поверхностью клетки реципиента. Белок tra S подавляет запуск конъюгационного метаболизма ДНК.
Клетки доноры F+ становятся фенокопиями F — в поздней стационарной фазе развития при культивировании и имеют реципиентную способность. В фенокопиях продукт гена tra T также синтезируется, однако функционально не активен.
Поверхностное исключение обнаружено также в случае I-подобных плазмид.
Летальный зигозиз может проявляться если в скрещиваниях используются клетки реципиенты F-. Однако, если клетки, используемые в качестве реципиентов, содержат плазмиду F — они имунны к летальному зигозису.
Несовместимость и группы несовместимости.
К одной группе несовместимости (inc-группа) относят плазмиды, которые несовместимы между собой, но совместимы с любой плазмидой из другой группы.
Существует более 30 inc-групп:
| Группа | Плазмида |
| B | R16, Tpll3, Tpl25, R723, R864a |
| C | R40a, R55, RAl, pIP55, pIP40a, pHH1343a |
| D | R711b, R778b |
| E | JA4320 |
| F1 | F, ColV2, ColV2-K94, ColV3-K90, ColV3, R386, R455, R773, R162, P307Ent, IP162, pAPl0-2, plP174, pHH507, PGH2387 |
| FII | R192, NR1, Rl, Rldrdl9, R6, R6—5.1, SF119, R136, Rl-19k, R538Fdrdl, pHH1313d, pGD10 |
| FIII | ColB-K98, MIP240Hly, R ColBM |
| FIV | R124, pJLl/Vir/, pAP17 |
| FV | Folac, plT509, pIE1510 |
| FVI | Hly-P212, pGL611, pSU212Hly, pSU105, Hly |
| FVII | PAP38 |
| FVIII | PAP43 |
| FIX | PAP42 |
| FX | PAP19-1 |
| G | Rmsl49 |
| HI1 | R27, R726, pPG 1251-2, TP123 |
| HI2 | R478, pAS251-2, pSD114. N-1, pWR23 |
| HI3 | MIP233 |
| HII | PHH1457, pHH15O8a, pHH1532b-l, R62, R64, R144, R483, ColIb-P9 |
| Il/I | R62, R64, R144, R483, ColIb-P9 |
| Ig | R621a, ColIb-Iml420 |
| Id | JR66a, R721 |
| It | R905a |
| I2 | TR114, R769, pHlyl52 |
| J | R391, R997 |
| K | R387, pTM559, pIE316, pkmr |
| M | R69, R446b, R471a, R831b, R46, pDT201,R390 |
| N | N3, N3T, R15, R46, R477b, pKM10l, PCU1, RPC3, pIP113, R390 |
| P | RP4, R751, R690, RP1, R18, pUZ8, pK2, R68, R702, R906 |
| Q | R678, NPT7, R300b, NTP2, R839, R938, R995, R1033, RSF1010, R1I62, pKT214, R702, R751, R906, R772 |
| S | R1033, R751, R906, R772 |
| T | Pts-1, R394, R401, R402 |
| U | PAr-32, pA3, R1460, pIE42O |
| V | R757, R753 |
| W | RSa, R7K, R388, plP100b, pIP339 |
| X | R6K, R485, TP231, TP228, TP227, R711b, TEMdrd, pHH1187 |
| Y | PIcm P7, R753, R905, PI5b, pIP231, MIP231 |
Когда плазмиды не трансмиссивны в E. Coli их классифицируют в бактериях тех видов, в которых они выявлены. Плазмиды псевдомонад, не способные к переносу в E. Coli, классифицированы в Pseudomonas aeruginosa и других псевдомонадах на 11 групп.
Плазмиды стрептококков и стрептомицетов также классифицированы на несколько inc-групп.
Для плазмид одной группы исключения сходна молекулярная масса, гомологичны многие последовательности нуклеотидов, сходны конъюгационные процессы, синтезируются серологически родственные пили. Как полагают многие исследователи, принадлежность плазмиды к той или иной группе несовместимости является отражением филогенеза последней.
Иногда проявляется атипичная несовместимость, когда плазмиды оказываются несовместимыми с плазмидами других групп несовместимости. Иногда одну плазмиду относят к нескольким inc-группам.
На данный момент предложено две модели механизма несовместимости:
Репликоновая – основана на гипотезе позитивного контроля. Предполагается, что несовместимость обуславливается конкуренцией плазмид за сайты прикрепления к мембране клетки. Однако, к настоящему времени имеются данные, не укладывающиеся в такую модель.
Модель «разведения репрессора» — негативный контроль. Если плазмиды имеют одинаковые системы контроля копийности и, следовательно, обладают взаимной чувствительностью к детерминированию и репрессорам, то они будут несовместимы (т. к. в дочерние клетки разойдутся не копии одной плазмиды, а гомологичные несовместимые плазмиды, а синтез копий до деления клетки и тем самым разведения репрессора будет подавлен)
Молекулярная и генетическая
Организация плазмид.
Генетическая организация разных плазмид отличается большим разнообразием, так как среди плазмид, на основе их функциональной специфичности, различают факторы генного переноса, представляющие собой структуры, содержащие лишь гены репликации и переноса, благодаря которым обеспечивается непрерывность поддержания плазмид этого типа и распределение их между дочерними клетками, а так же их трансмиссивность и генетические детерминанты различных свойств.
Конъюгационные коинтегративные плазмиды – коинтеграты, состоящие из фактора генного переноса(RTF) и генов, детерминирующих фенотипические свойства бактерий. Каждый из составных компонентов такой плазмиды содержит в своем геноме гены репликации.
Неконъюгационные плазмиды — генные детерминанты различных свойств. В бактериальных клетках они лишены способности придавать клеткам свойства генных доноров (они не способны к самостоятельной передаче, но, благодаря наличию генов репликации, стабильно поддерживаются в клетке и передаются дочерним клеткам).
Молекулярная организация.
Плазмиды – молекулы ДНК, с размерами от 1 ![]() 350 МД и более (1000
350 МД и более (1000 ![]() 550000 нуклеотидов). Чаще всего размеры лежат в пределах от 3
550000 нуклеотидов). Чаще всего размеры лежат в пределах от 3 ![]() 6 МД и от 50
6 МД и от 50 ![]() 70 МД (последнее множество размеров принадлежит конъюгационным плазмидам).
70 МД (последнее множество размеров принадлежит конъюгационным плазмидам).
Молекуле плазмидной ДНК присущи различные конформации: может быть 2-хцепочечная кольцевая форма (в результате смыкания одной из цепей ДНК – «релаксированная» форма), в результате смыкания обеих цепей образуется ковалентно закрытая сверхспиральная кольцевая форма.
![]()



|
![]()

![]()
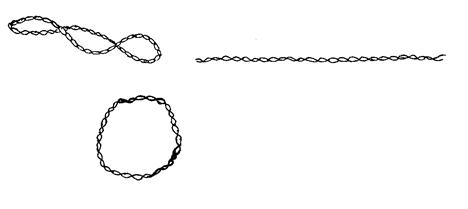
Для большинства бактерий и плазмид обычна суперспирализированная форма. У микроорганизмов ряда видов встречаются плазмиды в линейной форме, например, у стрептомицетов – плазмида SCP1.
Значительная часть сверхспиральной ДНК отдельных плазмид находится в «релаксационном» комплексе с белком.
Кольцевая форма молекулы ДНК плазмиды характерна лишь для бактерий, но не для грибов и растений, где она существует в линейной форме.
Генетическая организация
Факторов переноса.
К чистым факторам переноса относят, например, факторы F и F-подобные (pAP22-4, pAP38, pAP39, pAP41) и pTRA1, фактор T, идентифицированный в E. coli, Shigella, Salmonella, Proteus, Klebsiella, Aerobac-ter, фактор D, обнаруженный в S. typhimurium, и pAA1000 – в S. suipestifer (Пехов А. А. 1981), в Pseudomonas – фактор АP, а в Vibrio – фактор P и др. Наиболее полно их генетическая организация изучена на примере F-плазмиды, у которой не только изучены гены переноса – tra, репликации – rep, несовместимости – inc и др. но и картированы. Имеется 22 гена tra: M, J, A, L, E, K, B, V, C, W, U, N, F, H, G, S, T, D, I, Y, Q, Z. Гены tra A, L, E, K, B, V, C, W, F, Q, H, G – детерминируют синтез белков F-пилей, например, F-подобные pED208 – детерминируют синтез 17 пилей (в случае 0.5 – 1.5 пили в среднем на клетку), гены tra N и G детерминируют устойчивость конъюгационных пар клеток (донор – реципиент), tra M, Y, G, P, I, R, U – контролируют метаболизм конъюгации, tra S, T – поверхностное исключение, tra J — генетическая регуляция переноса плазмид.
Генетическая организация конъюгативных
Коинтегративных плазмид.
Эти плазмиды представляют из себя коинтеграты факторов переноса и детерминантов различных свойств, контролируемых плазмидой. С этой стороны наиболее полно изучена F — и I-подобные плазмиды лекарственной резистентности. R-плазмиды – коинтеграт 2 макромолекул (RTF + генетические детерминанты r). Основной тип фактора R является сложной структурой, в которой несколько генетических элементов объединено в одну кольцевую макромолекулу.
 |
 |
Альтернативные молекулярные формы фактора R3W.
Единая структура раздельные компоненты
репликона
В некоторых случаях в коинтеграты входят несколько элементов, способных к независимой репликации (имеют rep-гены). Таким образом, коинтеграты в клетке хозяина могут быть стабильными (I вариант) и разделенными на отдельные репликоны (II случай). Имеющиеся данные свидетельствуют, что система переноса F-подобных R1, RG, R100 в принципе сходны с F плазмидой и имеют сходные наборы и последовательности генов tra, и детерминируют синтез сходных (толстые, гибкие) пилей.
Система переноса I-подобных плазмид сходна с системой F-подобных, однако, для нее характерны особенности: синтез толстых и тонких пилей, морфологически и антигенно-отличных от F-индуцируемых и др. У других inc-групп также встречаются отличия.
Цитоплазматические элементы, обладающие естественной способностью автономной репликации и самопередачи, могут «выхватывать» из хромосомы отдельные гены, контролирующие синтез какого-либо вещества, или фрагменты, включающие несколько генов. Трансмиссивные элементы, не нагруженные генами, контролирующими резистентность к лекарственным веществам (типа фактора А Андерсона), теоретически также могут быть интегрированы с хромосомой в локусах, расположенных рядом с хромосомными генами, контролирующими лекарственную устойчивость. При переходе из интегрированного состояния в автономное трансмиссивный элемент может включать в свою структуру прилегающий к нему участок хромосомы, несущий гены резистентности. Путем последовательной «достройки» трансмиссивного элемента может образоваться новая генетическая структура с несколькими генами резистентности плазмиды R. В отношении реальности такого пути формирования новых факторов резистентности высказываются критические соображения, хотя генетические доводы относительно возможности возникновения плазмид коинтегрированного типа не противоречат гипотезе «выхватывания генов».
Одно из соображений, не укладывающихся безоговорочно в концепцию, заключается в том, что механизмы резистентности, контролируемой плазмидами R, часто существенно отличаются от механизмов формирования хромосомной резистентности. В первом случае факторы R включают гены, контролирующие синтез энзимов, инактивирующих антибиотики, тогда как соответствующая хромосомная резистентность
возникает в результате модификаций рибосомальных структур.
Правомерна и другая теоретическая модель, несколько отличающаяся от рассмотренной выше. Ее построение основано на том, что у многих видов бактерий в цитоплазме присутствует внехромосомная ДНК в виде независимо реплицирующихся автономных репликонов. Некоторые из них могут нести функции фактора передачи или иметь форму неинфекционного внехромосомного элемента, например, обладающего антагонистической активностью (как факторы колициногенности). В структуре таких репликонов возможно наличие генов, контролирующих резистентность к антибиотикам, или солям тяжелых металлов. Присутствие в клетке трансмиссивных плазмид создает условия для передачи неинфекционных плазмид путем их мобилизации. Аналогично этой ситуации присутствие независимого фактора передачи и независимого неинфекционного фактора лекарственной устойчивости в одной клетке может быть основой для. формирования генетического элемента со свойствами фактора R, обладающего одновременно инфекционностью и способностью, контролировать лекарственную устойчивость. В некоторых случаях возможна последующая интеграция отдельных репликонов с другими, в результате чего могут сформироваться сложные репликоны со структурами плазмидных коинтегратов. При отсутствии коинтеграции возможно формирование генетических комплексов, которые могут быть отнесены к типу плазмидных «агрегатов».
Передаваясь от клетки к клетке, плазмиды распространяются «эпидемически» (по выражению Fredericq) в популяции чувствительных бактерий по типу вирусных агентов. Благодаря этому свойству конъюгативные плазмиды именуются инфекционными.
Многие плазмиды, обладающие свойством самопередачи (за исключением F), в большинстве клеток донорской популяции репрессированы. Их активность регулируется системой оператор – репрессор, в которой соответствующая группа генов включается периодически в зависимости от накопления в клетке специфических субстратов, контролирующих их функции.
Генетическая организация
Неконъюгационных плазмид.
Эти плазмиды не содержат RTF, только различные генетические детерминанты (например r) и rep-систему.
К ним относятся такие плазмиды как, ColE1, pSE101, SuSm и тд. Наиболее изучены ColE1, CloDF13. Для них характерна кластерность генов на генной карте. Например, район, отвечающий за репликацию, включает O-пункт и детерминанты, контролирующие репликацию. К этому району примыкает отвечающий за колициногенность.
Поддержание в клетках.
Выдающееся свойство плазмид – поддержание в бактериальных клетках в определенном числе копий. Здесь важны процесс репликации и точного распределения между дочерними клетками. У F-плазмиды имеется процесс, контролируемы плазмидой в виде пары генов ccd, определяющий отсеивание клеток, утерявших плазмиду. Заключается в деструкции клеток, в которых произошла ее элиминация. Когда клетка теряет плазмиду, происходит активация продуктов генов ccd, что влечет к запуску механизма самоубийства в клетке и далее в ее потомках.
Репликация. Базовый репликон.
Репликационный цикл ДНК плазмид, как и хромо-сомной, состоит из инициации, элонгации и терминации.
При удвоении ДНК плазмид образуется ковалентно закрытые, но не сверхскрученные, молекулы, которые затем конвертируются в молекулы сверхспирализованной ДНК. Процесс элонгации непрерывен. Для завершения цикла удвоения необходимо, что бы первичная элонгационная вилка достигла терминуса, а вторая начала движение от O-пункта в противоположном направлении вплоть до терминуса.
Все, что в настоящее время известно о репликации плазмид, выяснено, в основном, в ходе изучения так называемых мини-плазмид или мини-репликонов, конструируемых с помощью рестриктаз и лигазы из нормальных плазмид или введением в геномы плазмид транспозонов, вызывающих перестройки в плазмидной ДНК.
Для репликации плазмиды минимально необходима лишь часть плазмиды – базовый репликон. Наиболее полно он изучен на примере миниплазмиды F. Он в ней состоит из ряда элементов:
О-пункт – специфическая последовательность нуклеотидов, на которой происходит инициация репликации. У некоторых плазмид несколько O-пунктов (гены ori)
Структурный ген для позитивной функции (ген rep)
Детерминанты, негативно контролирующие количество плазмид (cop)
Детерминанты, обеспечивающие, распростране-ние копий (par)
Детерминанты ccd.
Что, касается гена rep, то предполагают, что он
Контролирует инициацию репликации. Посредством про-дукции белка rep E, связывающегося с ori.
С другой стороны, предполагается существование и другой схема, контроля копийности.
Найдено 5 прямых повторов, родственных повторам в локусе ori, формирующих локус cop. Считают, что cop конкурирует с локусом ori за связывание белка repE, который обладает авторепрессорной активностью. Предполагается, что он имеет две формы, одна из которых имеет значение в инициации репликации, вторая – в репрессии гена rep (авторепрессорная активность).
Репликация плазмиды F и всех, происходящих от нее, мини-репликонов требует участия белка, кодируемого хромосомным геном dnaA и являющегося инициатором репликации бактериальной хромосомы.
Для плазмиды F характерно наличие двух O-пунктов репликации – oriS и oriV. С oriS репликация проходит в двух противоположных направлениях, тогда как с oriV – только в одном.
У большинства остальных плазмид репликация проходит по сходным схемам, с определенными отличиями, так существенные отличия наблюдаются при репликации P-подобных плазмид.
Распределение между клетками
В процессе деления.
Система распределения существует независимо от генетических структур, контролирующих репликацию. Ее существование подтверждается идентификацией плазмидных мутаций в виде делеций района par, которые прекращают распределение плазмид между дочерними клетками, но не влияют на количество их копий в родительской клетке, т. е. не влияют на копийность.
Как показывают исследования, район par минирепликона плазмиды F имеет длину порядка 3000 нуклеотидов и содержит 2 кодирующие последовательности parA и parB, а так же parC, детерминирующий синтез плазмидной центромеры. Сходная
Структура характерна для многих плазмид. Последовательности parA и parB кодируют белки, обладающие саморегуляцией на стадии транскрипции (так как их сверхпродукция привела бы к блокированию распределения). По одной из теорий предполагается, что после репликации плазмиды белки par связываются с сайтами распределения плазмид, в результате чего образуются комплексы узнавания. Последние формируют специфические димеры, которые связываются с одним из клеточных сайтов. Когда клетки делятся, то делятся и димеры, в результате чего, плазмидные копии поступают в новую генерацию клеток.