За последние два десятилетия был опубликован в России и за рубежом ряд результатов научных исследований, указывающих на особенность развития биоэффектов при воздействии на организм модулированных ЭМП (МЭМП) по сравнению с непрерывным режимом ЭМП.
Потенциальное значение этого феномена, по нашему мнению, еще не осознано научной общественностью в плане оценки электромагнитной опасности для населения. До сих пор не определенны подходы учета особенностей действия МЭМП при разработке соответствующих гигиенических стандартов. Важно, что при некоторых ситуациях биологический эффект будет определять не поглощенная энергия, а вид и характер модуляции ЭМП.
К сожалению, результаты проведенных в России исследований биологического действия модулированного ЭМП до сих пор не известны на Западе и в США. Исключением является лишь обзор Пахомова и Мерфи, который дал первую информацию о результатах этих исследований на английском языке*.
В статье представлен анализ результатов 28 экспериментов, в которых использовали модулированные ЭМП радиочастот низкой интенсивности**. Исследования были проведены как на моделях in vitro и in situ, а также на экспериментальных животных в условиях острых мало интенсивных воздействий МЭМП РЧ.
Эксперименты были проведены в Институте биофизики клетки РАН, Институте биофизики МЗ РФ, Институте физиологии РАМН, Институте медицинской радиологии РАМН, Санкт-Петербургском государственном Университете, Томском государственном Университете.
Результаты анализа работы могут быть условно разделены на две группы. В первую группу вошли результаты экспериментов по установлению роли модуляции ЭМП в развитии биоэффектов, а также по установлению особенностей действия модулированных ЭМП. В этом случае были проведены сравнительные эксперименты с использованием непрерывных и модулированных магнитных полей. Ко второй группе относятся результаты экспериментов, характеризующие биологическое действие только модулированных ЭМП. В этих опытах не проводилось сравнение биоэффектов, вызванных модулированными и немодулированными ЭМП.
Исследования in vitro и in situ
Был выполнен ряд исследований ферментативных систем под действием модулированных ЭМП с установлением наиболее эффективных частот модуляции. Была исследована зависимость активности моноаминооксидазы, аспартатаминотрансферазы, АТФазы актомизина и щелочной фосфатазы от частоты модуляции ЭМП РЧ при кратковременных воздействиях ЭМП низкой интенсивности. Воздействие в каждом опыте было равным для всех исследуемых частот модуляции вследствие установления равенства энергетических характеристик. Биохимические исследования активности ферментов были проведены с использованием стандартных комплексных наборов-регентов, субстратов и других соединений фирм “Sigma” (США) и “Диаком”(Россия).
Было показано, что слабоинтенсивное воздействие МЭМП на ферментативную активность моноаминооксидазы (МАО-А), участвующая в катализации первого этапа дезаминтрования моноаминов, зависит от частотной модуляции (Долгачева Л. П. и др., 2000). Крыс подвергали воздействию ЭМП 915 МГц, частоты модуляции 2, 4, 6, 8,12,16 и 20 Гц, S=10 мкВт/см2, время облучения — 10 минут.
Было установлено, что изменения активности МАО-А в гипокампе и гипоталамусе мозга крыс зависело от частоты модуляции (табл. 1).
Таблица 1
Изменение активности МАО-А в гипоталамусе и гиппокампе головного мозга крыс после воздействия импульсно-модулированного электромагнитного излучения
(в относительных единицах)
|
Частота импульсов, Гц |
Число крыс |
Число проб |
Структуры головного мозга |
|
|
Гипоталамус |
Гипокамп |
|||
|
Без облучения 2 4 6 8 12 16 20 |
5 3 4 3 2 3 4 4 |
20 12 16 12 8 12 16 16 |
0.65±0.33 0.53±0.02* 0.93±0.13** 1.04±0.13** 0.51±0.04* 0.97±0.07** 0.56±0.02* 0.49±0.01** |
0.59±0.02 0.65±0.01* 1.03±0.14** 0.61±0.04 0.74±0.06* 0.85±0.08* 0.90±0.11** 0.56±0.02 |
*Отличие данных от контроля по t-критерию Стьюдента достоверны p<0.05.
** То же p<0.01.
Наибольшее активирующее влияние на активность МАО-А в гипоталамусе оказывало МЭМП с частотами модуляции 4, 6 и 12 Гц. В контроле активность фермента составляла 0.65±0.03 относительных единиц (о. е.), то у экспериментальных животных 1.04±0.13 (p<0.01), соответственно. Воздействие с частотой 16 и 20 Гц сопровождалось понижением активности МАО-А до 0.56±0.02 (p<0.05) и 0.49±0.01 (p<0.01). Понижения активности МАО-А в гиппокампе не наблюдалось при воздействии ЭМП ни в одной из исследуемых частот. Таким образом, повышение активности МАО-А в гипоталамусе мозга крыс наблюдалось при частотах модуляции 4, 6 и 12 Гц соответственно до 143 (p<0.01), 160 (p<0.01), и 149 (p<0.01) % от контрольных значений, условно принятых за 100%. При частотах модуляции ЭМП 2, 8, 16 и 20 Гц отмечается понижение активности МАО-А до 82 (p<0.05), 78 (p<0.05), 86 (p<0.05) и 74 (p<0.01) % от контрольного уровня. Действие сверхслабого импульсно-модулированного ЭМП на активность МАО-А в гиппокампе мозга крыс было главным образом активирующим. Максимальное повышение активности фермента (до 174% по сравнению с контролем) зарегистрировано при частоте модуляции 4 Гц.
Таким образом, модулированное ЭМП малой интенсивности оказало влияние на ферментативную систему дезаминирования моноаминов. При этом выраженность биоэффекта зависела от вида модуляции.
Было исследовано влияние МЭМП на активность аспаратаминотрансферазы (АСАТ) сыворотки донорской крови человека (Пашовкина М. С., Акоев И. Г., 2001). Пробы сыворотки крови облучали ЭМП 2375 МГц, диапазон модуляции 50–390 Гц, S=2 и 8 мкВт/см2, время облучения 5 мин. Изменение активности АСАТ зависело от вида модуляции и от интенсивности (табл.2).
Несмотря на небольшое различие в плотности потока энергии, воздействие с ППЭ равным 2 мкВт/см2 было более эффективным, чем с ППЭ 8 мкВт/см2. При более низкой интенсивности воздействия было больше частот модуляции, повышающих активность фермента более чем на 200 % и не было ни одного случая снижения эффективности ниже контрольного уровня.
Таблица 2
Значения относительного изменения активности аспаратаминотрансферазы при разных частотах модуляции ЭМП и разной интенсивности воздействия, % к контролю.
|
Частота модуляции, |
ППЭ, мкВт/см2 |
|
|
2 |
8 |
|
|
(М±m) |
(М±m) |
|
|
50 |
146.6±6.7 |
175.3 ± 5.3 |
|
70 |
286.6±6.4 |
154.0± 14.0 |
|
90 |
162.6±3.8 |
184.0 ± 4.0 |
|
110 |
155.6±5.7 |
198.0 ± 3.6 |
|
130 |
235.6±3.5 |
76.0±6.2 |
|
150 |
125.3±3.7 |
325.0 ±5.7 |
|
170 |
247.3±8.3 |
371.1±5.5 |
|
190 |
345.6±3.4 |
156.4±5.4 |
|
210 |
133.7±3.5 |
503.7±4.9 |
|
230 |
292.8±7.0 |
254.6±6.2 |
|
250 |
243.3±6.2 |
127.3±3.4 |
|
270 |
187.7±5.0 |
100.6±7.5 |
|
290 |
158.3±2.2 |
162.7±4.9 |
|
310 |
129.7±4.7 |
254.3±5.6 |
|
330 |
217.3±8.5 |
211.0±7.2 |
|
350 |
114.7±3.5 |
77.7 ±3.5 |
|
370 |
479.4±8.5 |
139.6 ±1.6 |
|
390 |
400.4±8.4 |
592.3± 4.6 |
Аспаратаминотрансфераза показала очень высокую чувствительность к ЭМП и увеличивала свою активность при некоторых частотах модуляции почти в 4–6 раз.
Необходимо специально отметить, что направленность и выраженность эффекта сохранялась и в повторных дублирующих экспериментах в аналогичных условиях воздействия, но в различные периоды времени (в различные сезоны).
Исследовали влияние модуляции ЭМП от 30 до 310 Гц на направленность и выраженность реакции щелочной фосфатазы (ЩФ) сыворотки крови морских свинок сразу после кратковременного воздействия и дополнительно через 20 и 30 минут при различных интенсивностях, S=0,8; 8,0 и 40 мкВт/см2 (Пашовкина М. С., Акоев И. Г., 2001а). Была получена зависимость характера и выраженности реакции от частоты модуляции. Отмечена возможность значительного влияния модуляции на активность ферментов как в сторону ее повышения, так и в меньшей степени в сторону понижения (Рис.1 и 2, табл.3 и 4). Важно отметить, что на зависимость развития биоэффектов от вида модуляции влияла величена ППЭ (табл.3, 4). Эффективность воздействия МЭМП с ППЭ равным 0.8 мкВт/см2 была выше, чем при 8 мкВт/см2. Так, повышение активности фермента более чем на 20% отмечали уже при 7 частотах модуляции (при 1-минутном воздействии), в отличие от воздействия ЭМП с ППЭ 8 мкВт/см2, которое вызывало повышение активности выше 20% только на двух частотах, и оно было значительно ниже, чем при 0.8 мкВт/см2. Большую в 5–30 раз эффективность действия более слабого излучения отмечали и при одинаковых частотах модуляции в этих двух группах животных. Аналогичные результаты были и при трех минутном воздействии МЭМП.
Таблица 3.
Относительное изменение активности ЩФ (% от контроля) в зависимости от
интенсивности ЭМП и времени воздействия при разных частотах модуляции
(первая выборка со снижением активности ЩФ).
|
Частота |
ППЭ, мкВт/см² |
M±m |
M±m |
|
70 |
0.8 8.0 40.0 |
87.2±1.22 13.3±0.76 -33.1±0.67 |
112.0±0.83 15.3±0.31 -37.5±0.32 |
|
90 |
0.8 8.0 40.0 |
44.5±0.02 3.4±0.61 -26.8±0.29 |
57.8±0.93 33.8±1.82 -57.8±0.17 |
|
110 |
0.8 8.0 40.0 |
25.1±0.34 2.45±0.22 -25.4±0.35 |
27.7±1.31 2.6±0.03 -76.3±0.26 |
|
170 |
0.8 8.0 40.0 |
33.7±0.32 0.83±0.12 -29.4±0.08 |
42.4±0.28 4.6±0.02 -9.5±0.26 |
|
190 |
0.8 8.0 40.0 |
23.8±0.74 -5.6±0.31 -8.3±0.03 |
25.7±1.25 -8.3±0.08 -35.8±4.9 |
|
230 |
0.8 8.0 40.0 |
11.8±0.05 2.4±0.09 1.1±0.06 |
13.4±0.94 4.3±0.03 2.5±0.08 |
|
310 |
0.8 8.0 40.0 |
21.7±0.35 2.2±0.04 1.7±0.04 |
23.9±0.61 3.1±0.13 4.8±0.06 |
Таблица 4.
Относительное изменение активности ЩФ (% от контроля) в зависимости от
интенсивности ЭМП и времени воздействия при разных частотах модуляции
(вторая выборка, с повышением активности ЩФ).
|
Частота |
ППЭ, мкВт/см² |
M±m |
M±m |
|
30 |
0.8 8.0 40.0 |
-12.2±0.08 7.4±0.07 14.4±0.62 |
-5.9±0.05 9.1±0.08 26.2±0.07 |
|
150 |
0.8 8.0 40.0 |
-5.6±0.05 1.7±0.81 14.4±0.58 |
-6.4±0.04 3.2±0.14 27.2±0.45 |
|
250 |
0.8 8.0 40.0 |
-24.7±0.34 7.2±0.03 63.1±0.64 |
-17.5±0.12 9.7±0.16 79.1±0.15 |
|
270 |
0.8 8.0 40.0 |
6.3±0.03 15.8±0.03 28.6±0.64 |
12.1±0.22 18.4±0.03 39.5±0.01 |
|
290 |
0.8 8.0 40.0 |
15.4±0.02 20.3±0.06 40.0±0.09 |
-14.6±0.35 27.1±0.99 59.0±0.54 |
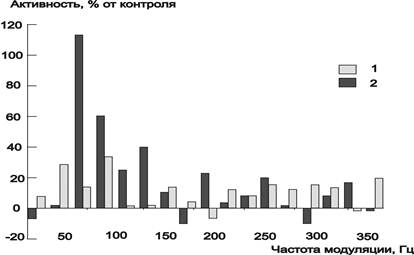
Рис.1. Зависимость активности щелочной фосфатазы сыворотки крови морских свинок от частоты модуляции при 3-х минутном воздействии ЭМП с ППЭ 8 мкВт/см2 (1) и 0.8 мкВт/см2 (2).
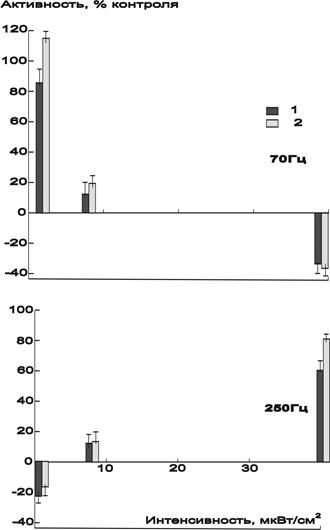
Рис. 2. Два типа зависимости активности щелочной фосфатазы сыворотки крови морских свинок от изменений интенсивности воздействия ЭМП при частотах 70 и 250 Гц с экспозицией 1 мин (1) и 3 мин (2).
Для изучения случаев инверсии направленности влияния модулированных микроволн при изменении интенсивности воздействия имеющиеся данные дополнили экспериментами по влиянию щелочной фосфотазы микроволн с ППЭ 40 мкВт/см2 при сохранении других условий. Общие материалы (табл.3 и 4) показали, что среди частот модуляции в иссследованном диапазоне 10–310 Гц имеются две группы частот, взывающие как понижение активности фермента (относительно контрольных изменений) при увеличении интенсивности воздействия ЭМП (от 0.8 мкВт/см2), так и повышение ее в таких же условиях. В первой группе частот изменение эффекта было противоположно росту энергетической дозы, а во второй группе изменения соответствовали полученной дозе.
Из полученных экспериментальных данных следует, что наиболее высокая биологическая эффективность облучения возможна в ряде случаев при наиболее низкой интенсивности воздействия. Анализ результатов экспериментов позволил авторам установить, что из всех использованных параметров воздействия в этом эксперименте (частота модуляции, продолжительность облучения, интенсивность воздействия) наибольшее влияние на активность щелочной фосфатазы оказывали частота модуляции и интенсивность воздействия. Так, для каждой частоты интенсивность воздействия ЭМП при изменении своей величины в пределах микроваттных уровней была способна круто изменять направленность влияния на активность фермента от выраженного стимулирующего действия к значительному ингибирующему влиянию и наоборот (Рис. 2). Все зависило от интервала интенсивностей для данной частоты модуляции. Увеличение продолжительности облучения с 1 до 3 мин влияло в меньшей степени и несколько повышало эффект воздействия ЭМП.
Эффективность частот модуляции может не проявлять своих активирующих или ингибирующих свойств в переходных зонах интенсивностей, где изменяется знак влияния. Для щелочной фосфатазы в проведенных исследованиях эта зона, примерно, находилось на уровне 5–15 мкВт/см2. Есть основания предполагать, что она мало зависила от частоты модуляции и от величины эффекта в других зонах интенсивностей, где проявляется эффект.
Авторами показана возможность сохранения направленности и эффективность действия частоты модуляции при дублировании экспериментов спустя значительный период времени.
In vitro изучали влияние МЭМП на АТФ-азную активность актомиозинового комплекса (Пашовкина М. С., Акоев И. Г., 1996). Препарат актомизина (АМ), выделенного из скелетной мышцы крысы, облучали ЭМП 2375 МГц, модуляция 50–300 Гц. Несмотря на высокую интенсивность ЭМП (S=40 и 200 мВт/см2), результаты данного эксперимента были включены в статью, т. к. в этой работе была получена четкая зависимость биоэффекта от модуляции.
В диапазоне частот 50–300 Гц при S=40 мВт/см2 АТФ-азная активность достоверно увеличивалась (Рис. 3) с максимум при частоте 270 Гц (285±25%, p<0.05). Однако было отмечено выраженное подавление АТФ-азной активности при частотах 130 и 300 Гц. В сериях опытов при S=200 мВт/см2 увеличение активности АТФ было более выражено в диапазоне частот 80–150 Гц (Рис. 4).
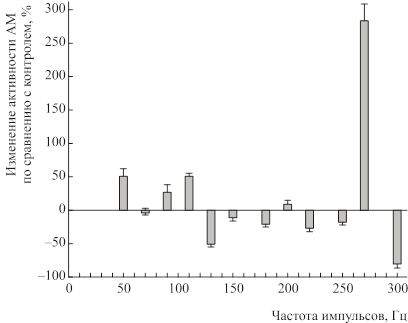
Рис. 3. Зависимость АТФ-азной активности АМ от частоты модуляции ЭМП (S=40 мВт/см2, t=1мин). По оси абсцисс – частота импульсов, Гц; по оси ординат – изменение активности АМ, % по сравнению с контролем.
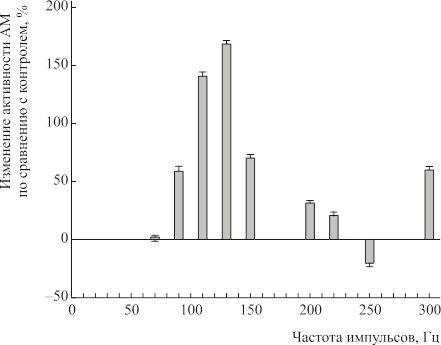
Рис. 4. Зависимость АТФ-азной активности АМ от частоты модуляции ЭМП (S=200 мВт/2, t=1мин). По оси абсцисс — частота импульсов, Гц; по оси ординат — изменение активности АМ, % по сравнению с контролем.
Было выявлено отчетливое влияние МЭМП на ГАМК-, глутамат — и холинергическую систему мозга крыс (800 МГц, S=1мВт/см²) в условиях острого воздействия (Юринская М. М., 1994; Кузнецов В. И. и др. 1991). Животных облучали в течение 5 минут как непрерывным ЭМП, так и импульсами прямоугольной формы с частотой 2.5; 3; 5; 7; 16 и 30 Гц. Исследования проводили сразу после воздействия ЭМП и «ложного воздействия».
Статистически достоверные и наиболее значимые изменения связывания рецептором ГАМК 3Н-мусцимола были получены при частоте модуляции 16 Гц (800 МГц, S=1 мВт/см2, время облучения 5 минут). Количество связанного мусцимола в опыте уменьшалось на 30-35% по сравнению с контролем (табл.5). Среднеквадратичное отклонение при частоте 16 Гц было минимально при сравнении с разбросом на других частотах модуляции.
Таблица 5.
Зависимость связывания 3Н-мусцимола рецептором ГАМК от частоты модуляции ЭМП (несущая частота 800 МГц, модуляция от 3 до 30 Гц, ППЭ 1 мВт/см2,
время облучения 5 минут).
|
Частота модуляции, Гц |
В* |
|
3 |
1.07±0.31 |
|
5 |
0.96±0.17 |
|
7 |
0.83±0.25 |
|
16 |
0.70±0.05 |
|
30 |
1.35±0.30 |
|
Без модуляции (CW) |
1.12±0.13 |
*Примечание: В — отношение связывания мусцимола с ГАМК-рецептором у облученных крыс к связыванию мусцимола с рецептором у контрольных (ложнооблученных) крыс.
При исследовании связывания глутамата крыс облучали 915 МГц, S=1мВт/см², время облучения 5 минут, модуляция 2.2 и 16 Гц наибольший эффект наблюдался при 16 Гц как и в случае связывания мусцимола, но эффект был противоположной направленности (Рис. 5). Количество связанного глутамата увеличилось на 200–220 %.
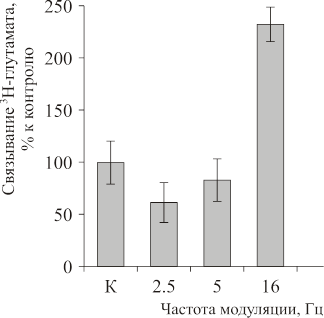
Рис.5. Зависимость связывания 3Н-глутамата синаптическими мембранами от частоты модуляции ЭМП (915 МГц, частота модуляции от 2.5 до 16 Гц, S=1 мВт/см2, время облучения 5 минут). По оси ординат — связывание 3Н-глутамата в % к контролю; по оси абсцисс — частота модуляции.
Было проведено дополнительное исследование влияния электромагнитных полей, модулированных низкой частотой, на синаптические рецепторы мозга при воздействии с различной величиной интенсивности и временем воздействия. (Юринская М. М. и др. 1996).
Крыс Вистар облучали ЭМП 800 или 950 МГц, модуляция прямоугольными импульсами 2.5, 3, 5, 7, 16 и 30 Гц при скважности 32%, S=10, 50 и 100 мкВт/см2. Время воздействия в разных сериях составляло 1, 5, 15 и 60 мин. Животных помещали в клетку из оргстекла, воздействие осуществляли из открытого волновода, состыкованного с волноводным трактом. Действию МЭМП подвергали одновременно трех животных. В контрольных опытах крыс в клетках помещали в безэховую камеру на соответствующее время без облучения.
Животных декапитировали сразу после воздействия МЭМП и «ложного» воздействия. В качестве рецептора ГАМК использовали 3H мусцимол. Опыты проводили на синаптонейросомах и синаптических мембранах. Связывание 3H глутамата осуществляли на синаптосомальных мембранах. Синаптонейросомы получали из коры головного мозга крыс.
Зависимость связывания 3H мусцимола и 3H глутамата от плотности потока энгергии ЭМП. Исследование влияния МЭМП при общем воздействии на организм показало, что и ГАМК — и глутаматергическая системы мозга крысы очень чувствительны к действию низкоинтенсивных МЭМП (рис. 6). При воздействии МЭМП изменения в связывании рецепторов с ГАМКА- и глутаматным рецепторами происходило различным образом: для ГАМКА- рецепторов наблюдалось уменьшение связывания, для глутаматных рецепторов — увеличение. ГАМК — и глутаматерическая системы мозга крысы реагировали на действие МЭМП противоположным образом, как это имеет место при стрессе и некоторых патологиях в ЦНС. Изменения в функционировании указанных систем зависили от мощности МЭМП: чем больше мощность излучения, тем более выражено было его действие. Максимальный эффект наблюдался при плотности потока энергии 1мВт/см2. Следует отметить, что модулированное ЭМП оказывало влияние на связывание 3H-мусцимола и 3H-глутамата и при меньших значениях мощности ЭМП. При значении плотности потока энергии ЭМП 10 мкВт/см2 уменьшение связывания 3H-мусцимола составило 88±12% по сравнению с контролем, а увеличение связывания 3H глутамата равнялась 120±12%.
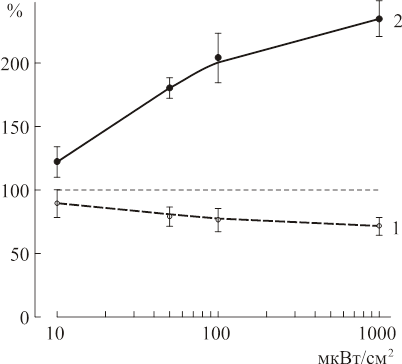
Рис. 6. Зависимость связывания 3H мусцимола (1) и 3H глутамата (2) от плотности потока мощности МЭМП (несущая частота 915 МГц, время облучения 5 мин, частота модуляции 16 Гц). Связывание у контрольных животных принималось за 100%. По оси абсцисс — плотность потока энергии, по оси ординат — связывание в % к контролю.
Зависимость связывания 3H-мусцимола и 3H-глутамата от времени воздействия ЭМП. Проведение исследования показали, что для ГАМКэргической системы максимальный эффект наблюдался при облучении животных в течение 1 мин — уменьшение связывания меченого мусцимола составляло 50–55% по сравнению с контролем, а при 15 и 60-ти минутном воздействии эффект был менее выраженным (рис. 7).
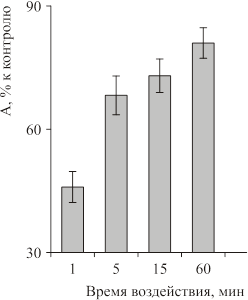
Рис.7. Зависимость связывания 3H глутамата синаптическими мембранами от времени воздействия ЭМП. А — отношение связывания лиганда с рецептором для облученных крыс к связыванию для контрольных животных (в % к контролю). Цифры в столбиках обозначают время облучения в минутах. Несущая частота 800 или 915 МГц, плотность потока мощности 1 мВт/см2, частота модуляции 16 Гц.
При исследовании связывания глутамата в зависимости от времени действия МЭМП, животных облучали в течение 1 и 5 мин, частота модуляции 16 Гц. Максимальный эффект наблюдался при 5 мин облучения, увеличение связывания составило 200–220% относительно контроля (при 1-минутном облучении увеличение связывания 3H глутамата равнялось 130±6%).
Таким образом, даже 1-минутного воздействия модулированного излучения достаточно, чтобы и при довольно низкой интенсивности микроволн существенно изменить реактивность ЦНС. При более длительном времени облучения МЭМП их действие становилось менее выраженным. Это может указывать на то, что в организме «включается» компенсаторный механизм в ответ на действие излучения.
Действие МЭМП на концентрационные зависимости связывания 3H — мусцимола и 3H-глутамата. В отдельных экспериментах был изучен вопрос о том, за счет чего происходит изменение количества связанного меченного лиганда — меняется ли сродство связывания лиганда или меняется количество связывающих участков в условиях воздействия модулированных ЭМП. Для этого были получены концентрационные зависимости связывания 3H мусцимола и 3H глутамата для контрольных и облученных животных и построены графики Скетчарда.
Константа диссоциации мусцимола изменилась незначительно (рис. 8) и составляла 480±60 нМ, что вполне согласуется с данными, полученными другими авторами. После облучения константа диссоциации мусцимола изменилась незначительно, но при этом изменилось количество связывающих участков. Число участков связывания для мусцимола снизилось от 17,4±0,8 пмоль/мг белка у контрольных до 10±2 пмоль/мг белка у облученных животных. Как видно на рис. 9, константа диссоциации глутамата у контрольных животных (227±15 нМ) больше значения константы диссоциации в опыте (103±10 нМ), т. е. после облучения сродство связывания возрастало. Что касается количества мест связывания для глутамата, то после облучения оно практически не менялось. Таким образом, как видно из приведенных данных, при облучении МЭМП изменяются как константы связывания, так и число связывающих участков.
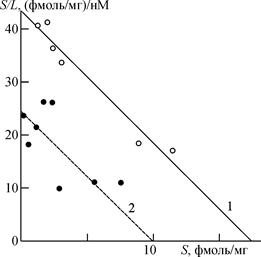
Рис.8. График Скетчарда для определения параметров связывания 3H мусцимола синоптическими мембранами. 1 — связывание 3H мусцимола в контроле, 2 — связывание 3H мусцимола после облучения. Несущая частота 915 МГц, плотность потока мощности 1 мВт/см2, частота модуляции 16 Гц, время облучения 5 мин. S — количество связанного лиганда, L — концентрация свободного лиганда.
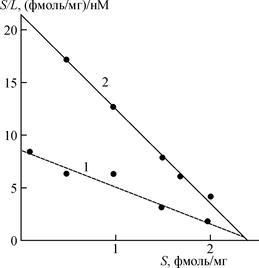
Рис.9. График Скетчарда для определения параметров связывания глутамата синаптическими мембранами. 1-связывание 3H-глутамата после облучения. Условия облучения как на рис.4. S-количество связанного лиганда, L — концентрация свободного лиганда.
К настоящему времени накоплено большое количество данных о действии микроволн на различные физиологические и биохимические параметры структур мозга, отдельные органы и целые организмы. Адекватное теоретическое объяснение полученных результатов представляет сложную проблему. Тем не менее, эти результаты хорошо согласуются с литературными данными по влиянию стрессовых (электрошок, болевой стресс, иммобилизация) на рецепторные свойства ГАМК – рецепторов. Эксперименты по облучению животных МЭМП показали, что наибольшее изменения концентрации ГАМК-рецепторов происходят в течение первых пяти минут. Далее при 15 и 60-ти минутном облучении эффект становился менее выраженным. Интересно, что подобная зависимость в изменении рецепторных свойств ГАМК-рецепторов в коре головного мозга наблюдается при 24-х часовом иммобилизационном стрессе: существенное уменьшение концентрации ГАМК-рецепторов в первые минуты, затем постепенное возвращение к норме, а к 24-му часу даже увеличение по сравнению с контролем. Фактически различные стадии изменения рецепторных свойств ГАМК-рецепторов при воздействии МЭМП схожи со стадиями общего адаптационного синдрома.
Таким образом, показано, что влияние МЭМП на рецепторные системы мозга зависит как от интенсивности, так и от длительности воздействия ЭМП. Можно предположить, что модулированное электромагнитное излучение «включает» в организме комплекс стрессовых реакций, которые далее, вероятно, развиваются по сценарию общего адаптационного синдрома.
Исследовали влияние импульсно-модулированного ЭМП слабой интенсивности на вторичные структуры ДНК (Семин Ю. А. и др. 2002).
Образцы ДНК (3 мл) в полипропиленовых пробирках диаметром 12 мм помещали в пенопластовый штатив (контрольный и опытный) так, чтобы они располагались в ряд с расстоянием между центрами пробирок 25 мм. Образцы подвергали воздействию импульсного или непрерывного ЭМП интенсивностью 600 мкВ/см² на частоте 1.05; 2.05 или 2.39 ГГц в течение 30 мин при 18ºС в безэховой камере. При импульсной модуляции поля частота подачи импульсов составляла 4 Гц, длительность импульсов 25 мс, S=600 мкВ/см². Штатив с опытными пробирками облучали в зоне сформированной волны (3 м от аппретуры излучающей антенны) в изодозовом поле (±10%) при вертикальной ориентации E-вектора. Контрольные пробы, также находившиеся в камере во время облучения, защищали ферритовым экраном. Исследования проводили сразу после воздействия.
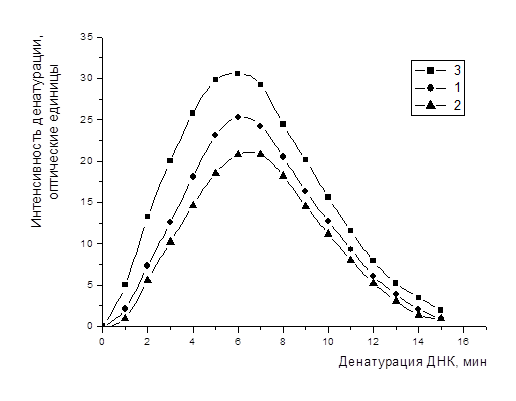
Рис.10. Кинетики денатурации контрольных (1) и подвергнутых воздействию непрерывного (2) и модулированного частотой 4 Гц (3) образцов ДНК (ЭМП 1.05 ГГц, S=600 мкВт/см2).
В экспериментах использовали ДНК, выделенную из тимуса мышей фенольным методом. В результате проведенных исследований было получено возрастание значения максимума кривых денатурации образцов ДНК и быстрое достижение максимума при импульсной модуляции (Рис.10). Противоположный эффект был получен при непрерывном воздействии. Было установлено, что импульсное излучение при всех трех использованных несущих частотах вызывает статистически значимые различия между кинетиками денатурации ДНК в облученных и контрольных растворах.
Авторы специально отмечают, что полученный биоэффект устойчиво воспроизводим и высоко достоверен при использовании выбранного режима воздействия.
Заслуживают внимания, с нашей точки зрения, результаты эксперимента, в котором изучали влияние «качающейся» частоты ЭМП на ДНК, выделенную из молок лососевых рыб (Ким Ю. А. и др., 2001). Влажную пленку ДНК, стабилизированную связанной водой, облучали «качающейся частотой» в диапазоне 8.15–10 Гц при ППЭ 5, 10, 20 или 40 мВт/см2 с длительностью 1, 5, 15, 30 и 60 минут.
Этот вид воздействия уже при S=5 мВт/см2 замедлял скорость десорбции воды в пленках ДНК, влиял на конформационные превращения полимерных молекул. Облучение блокировало конформационный переход молекул ДНК из гидратированной В-конформации в А-конформацию при высыхании пленок. В облученных пленках в процессе высыхания (уменьшение относительной влажности пленки) молекулы ДНК продолжали оставаться связанными с молекулами воды и, следовательно, сохраняли высокоупорядоченное состояние в отличие от контроля. Поскольку не было обнаружено каких-либо достоверных изменений в самой молекулярной структуре ДНК, это дало право авторам считать, что выявленные эффекты влияния ЭМП на возможность конформационных переходов обусловлены изменением структуры воды, связанной с ДНК. Возможно, это и служит причиной снижения скорости десорбции воды из пленок ДНК и стабилизации молекул ДНК в гидратированной высокоупорядоченной двуспиральной В-конформации. Предполагается, что способность ЭМП определенных параметров стабилизировать структуру ДНК будет влиять на функциональные свойства ДНК как носителя генетической информации.
Кроме биохимических исследований in vitro были проведены эксперименты по характеристике реакций изолированных структур нервной системы при воздействии МЭМП. Прежде всего была исследована роль модуляции ЭМП как возможный фактор, влияющий на фоновую импульсную активность (ФИА) нейронов среза головного мозга (Захарова Н. М. и др. 1993; Захарова Н. М. 1955, 1998).
Воздействие осуществляли ЭМП 0.9 ГГц в непрерывном режиме и с импульсной модуляцией 7, 16, 30 и 60 Гц. Скважность всегда была равна 5, длительность импульса была различной: при 7 Гц — 28 мс; при 16 — 12 мс; при 30 Гц — 6.7 мс. Удельная поглощенная мощность (УПМ) была равна 1.4 Вт/кг. До, во время и сразу после воздействия исследовали фоновую импульсную активность (ФИА) 80 нейронов в экспериментах с модулированным воздействием и 28 нейронов с немодулированным воздействием. ФИА регистрировали безартефактными электродами. Электрическую активность нейронов записывали на магнитофон для последующей обработки на ЭВМ. Проводили поминутное интегрирование текущей частоты каждого нейрона.
При воздействии ЭМП с модуляцией 7 Гц нейроны в большинстве случаев (13 из 17 клеток) уже на первой минуте облучения реагировали уменьшением частоты разрядов на 27%. Такое изменение частоты сохранялось в течение всего времени облучения. После прекращения воздействия тенденции к восстановлению частоты не наблюдалось (Рис.11, А). Остальные 4 клетки не прореагировали на облучение.
При частоте 16 Гц у 15 из 17 клеток воздействие вызвало уменьшение частоты фоновой активности на 24% на первой минуте облучения и на 65% к концу четвертой минуты воздействия. Тенденции к восстановлению ФИА также не прослеживалось (Рис. 11, В). Воздействие с частотой модуляции 30 Гц вызывало реакцию торможения ФИА лишь у 7 из 16 исследуемых клеток примерно на 28%. В этом случае тенденции к восстановлению также не прослеживалось после выключения генератора (Рис.11, C). Остальные 9 клеток в этой серии в ответ на воздействие достоверно не прореагировали.
Воздействие с частотой 60 Гц вызвало статистически значимое относительно контроля кратковременное уменьшение частоты ФИА менее чем у трети (у 5 из 19) исследуемых клеток примерно на 20% в первую минуту после прекращения облучения. Имелась тенденция к восстановлению частоты на 2-ой минуте после облучения (Рис.11, D).
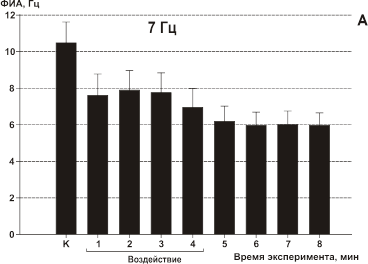
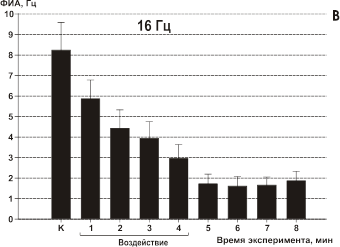
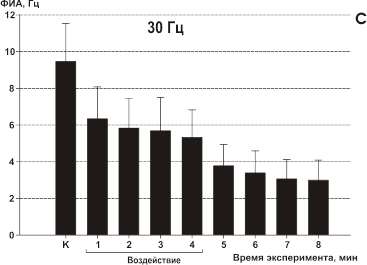
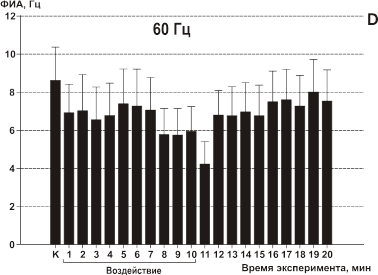
Рис 11. Влияние ИМ ЭМП на фоновую импульсную активность (ФИА) срезов неокортекса. Каждый столбец диаграммы — среднее значение частоты ФИА всех исследуемых в данном тесте клеток за минуту и стандартное отклонение среднего: К — в контроле, во время облучения (линия под графиками), последующие столбцы отражают время после облучения ИМ ЭМП. Частоты модуляции указаны над каждой диаграммой. Средняя УПМ составляла 1.4 мВт/г для всех частот модуляции. А — модуляция 7 Гц; B — модуляция 16 Гц; С — модуляция 30 Гц; D — модуляция 60 Гц.
В экспериментах с непрерывным облучением средняя УПМ подбиралась равной средней УПМ, используемой в экспериментах с модулированным облучением (1.4 мВт/г). В исследованиях с непрерывным облучением также обнаружено торможение ФИА у 16 из 28 клеток (Рис.12), но динамика изменения частоты, наблюдаемая при поминутном интегрировании была более монотонной, чем при модулированном облучении. При немодулированном облучении прослеживалась тенденция к восстановлению частоты ФИА после облучения к уровню контроля. Значимое торможение наступало только к четвертой минуте облучения и усиление эффекта не наблюдалось после прекращения облучения.
Была сделана попытка выявить изменения импульсации нейронов головного мозга при воздействии МЭМП с использованием кросскорреляционного анализа. (Захарова Н. М., 1996; Захарова Н. М. и др. 1996а).
В качестве модели исследования были использованы переживающие фронтальные срезы сенсомоторной коры головного мозга морской свинки.
Облучение проводилось ЭМП 900 МГц, УПМ в ячейке объемом 1 см3 со срезами была 1.4 мВт/г, импульсная модуляция 7, 16, 30 и 60 Гц.
Исследования проводили до, во время и сразу после воздействия МЭМП.
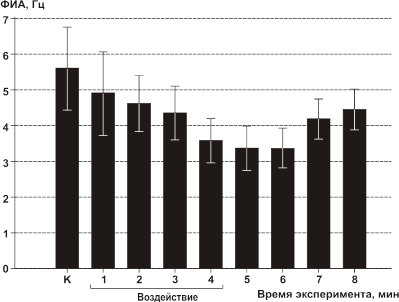
Рис 12. Среднее значение частоты ФИА нейронов срезов неокортекса во время и после воздействия немодулированного ЭМП за каждую минуту. К — до облучения; во время (1–4 мин) и после (5–8 мин) облучения со средней УПМ 1.4 мВт/г; по оси абсцисс — время исследования.
Спонтанную активность пар нейронов регистрировали внеклеточно одним стеклянным микроэлектродом. Вычисляли кросскорреляционные функции (ККФ) клеток. Был проведен статистический анализ ККФ, полученных от 51 пары соседних клеток, импульсные потоки которых были отчетливо разделены с помощью амплитудной дискриминации.
В ККФ с уровнем значимости 5% были обнаружены достоверные отклонения от среднего уровня h12, свидетельствующие о взаимозависимости в импульсации исследуемых пар клеток. На всех частотах модуляции в большинстве случаев наблюдалось уменьшение величены коэффициента корреляции во время воздействия с отсутствием четкой тенденции к восстановлению степени связанности пар нейронов после прекращения воздействия.
Снижение корреляции при облучении может свидетельствовать, что МЭМП десинхронизируют работу корковых нейронов в нейронных ансаблях. Изменение корреляции в активности исследуемых нервных клеток при микроволновом облучении, по-видимому, связано с влиянием излучения на синаптическую передачу между нейронами. Одной из причин ухудшения проведения синаптического сигнала в нервной ткани может быть угнетение энергетического метаболизма либо истощение пула нейромедиаторов.
Таким образом используя регистрацию спонтанной импульсной активности нейронов переживающих срезов неокортекса и кросскорреляционный анализ, было показано, что электромагнитное излучение оказывает заметное снижение межнейронной корреляции и соответственно происходит ухудшение синаптической передачи между клетками коры.
В целях исследования возможного влияния модулированного ЭМП малой интенсивности на более сложную функционирующую систему была использована модель изолированного сердца лягушки (Африканова Л. А., Григорьев Ю. Г., 1996). В опытах был использован сложный режим модуляции при низком уровне интенсивности. Был применен принцип изменяющейся во времени частоты модуляций при постоянном сужении набора частот. Облучение проводили на экспериментальной установке, генерирующей микроволны с частотой 9.3 ГГц. Так как размеры сердца лягушки сопоставимы с длиной волны излучения, облучение проводили в условиях, приближающихся к максимальному поглощению объектом энергии излучения.
Модулированное ЭМП по амплитуде характеризовалось меняющейся частотой модуляции от 1 до 100 Гц при глубине модуляции 30 и 100%; форма импульса прямоугольная, меандр, S=0,016 мВт/см². Расстояние до объекта выбиралось таким, чтобы облучение его было равномерным. Общая схема условий экспериментов приведена в табл.5.
Таблица 5
Общая характеристика условий экспериментов
|
№ эксперимента |
Число |
ППЭ, МВт/см² |
Режим генерации ЭМП И время облучения в мин |
Общее время |
|||
|
Опыт |
Контроль |
Постоянный |
Импульсный, Гц |
Время в каждом режиме, мин |
|||
|
1 |
28 |
28 |
0.016 |
— |
6–10 |
1 |
5 |
|
2 |
32 |
32 |
0.016 |
— |
1–10 |
1 |
10 |
|
3 |
20 |
20 |
0.016 |
— |
1–10, 20, 30, 40, 50, 60, 70, 80, 90, 100 |
1 |
19 |
|
4 |
10 |
10 |
0.016 |
+ |
— |
5 |
5 |
Исследования проводили во время облучения, и после воздействия в течение 24 часов. Всего было использовано 180 сердец лягушек.
Оценивали частоту биения сердца в течение каждого получаса в течение 6 часов от момента изготовления препарата изолированного сердца, во время воздействия, а также в течение суток после облучения. Одновременно наблюдения проводили в контроле (ложное воздействие) в те же сроки. Является важным для оценки реакции на облучение, что сердце в растворе Рингера может сокращаться в течение двух суток.
Кроме того, морфологическим критерием состояния возбудимых тканей сердца являлась оценка процесса витального окрашивания структур межпредсердной перегородки красителем азиновой группы нейтральным красным (НК). Метод прижизненного окрашивания давал возможность судить о жизнеспособности структур по критерию гранулообразования, а также о состоянии их проницаемости (по степени и динамике окрашивания). Другой витальный краситель — метиленовый синий — был использован для оценки состояния холиэнергитических синапсов на автономных нейронах узла Людвига.
Интактные неокрашенные сердца за 24 часа наблюдений замедляли свой темп в среднем на 7%; остановки сердца не было (рис. 13). Получасовые пребывания изолированного препарата сердце в растворе красителя само по себе приводило к изменению его функции. Число сокращений уменьшалось на 30%, а 14% сердец переставали сокращаться (Рис. 13). При стимуляции остановившихся сердец сильным светом или механическим раздражителем области пейсмекера (венозный синус) биение их восстанавливалось. По прекращении процесса окрашивания сердца постепенно наращивался темп сокращений, достигая исходного уровня. И лишь к концу опыта через 24 часа число сердцебиений снижалось в среднем на 20%.
Реакция сердец, облученных в непрерывном режиме, была незначительной и мало отличалась от окрашенных необлученных сердец.
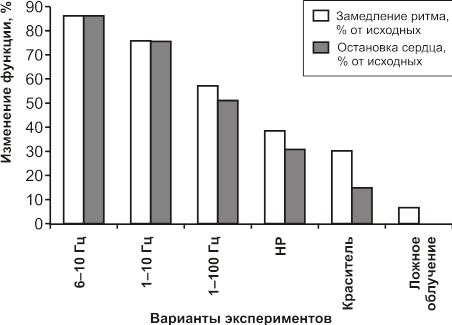
Рис. 13. Изменение частоты сердцебиений и остановок изолированных сердец лягушек, облученных ЭМП в непрерывном режиме (НР) и с различной импульсной модуляцией от 1 до 100 Гц.
При облучении в модулированном режиме было отмечено резкое уменьшение числа сердцебиений, увеличивалось также число сердец, переставших биться (Рис.13). Наибольший эффект был получен при изменении частоты модуляции в диапазоне 6–10 Гц и времени воздействия 5 минут. При этих условиях воздействия происходило замедление ритма с последующей остановкой сердца у 85% сердец (при непрерывном режиме — 38%). Эффекты эти были частично обратимы.
Отмытые от краски облученные сердца возобновляли сокращения, наращивали темп, однако, в течение 2–3 последующих часов в большом проценте случаев отмечали резкое урежение сердцебиений и вторичную остановку сердца. В этих случаях стимулирующие процедуры вели лишь к непродолжительному возобновлению сердечных сокращений. Через 2–3 часа после воздействия МЭМП в нейронах и мышечных элементах сердца наблюдали нарушение процесса гранулообразования. Большое количество нейронов приобретало угловые формы и имело диффузную окраску ядра и цитоплазмы. В мышечных волокнах число гранул красителя было уменьшенным, цитоплазма была слегка подкрашена и многие мышечные ядра также были окрашены в интенсивно красный цвет. Одновременно с этим были отмечены явления желатинизации синапсов на клетках узла Людвига и интенсивное подкрашивание шванновских клеток в зоне конуса аксона. Такого рода результаты могут говорить о нарушении жизнеспособности облученных структур сердца, о развитие процесса типа паранекроза.
Таким образом, во всех сериях опытов облучение сердец МЭМП со сменяющейся частотой модуляций в пределах от 1 до 100 Гц оказывало существенно большое влияние на функцию сердца, нежели облучение в непрерывном режиме генерации.
Исследовали значение в формировании биоэффекта корреляции между исходным состоянием системы организма и соответствующей модуляцией ЭМП (Африканова Л. А., Григорьев Ю. Г., 1996). В этих целях также была использована модель изолированного сердца лягушки. Изолированное сердце лягушки облучали ЭМП 9,3 ГГц, S=0.016 мВт/см2 с модуляцией в трех режимах: (а) 20, 22, 24 и 25 Гц; (б) 32, 34, 36 и 38 Гц; (в) 40, 42, 44, 46 и 48 Гц. В исходном состоянии по частоте биений сердца они были разделены на 3 группы: (I) 20–30 биений в 1 мин; (II) 31–40 и (III) 41–50. Режимы выбирали в соответствии с исходной частотой биения изолированного сердца. Продолжительность каждого облучения была равна 1 минуте. Также было воздействие с непрерывным режимом ЭМП (группа IV) и «ложное» облучение (группа V). Величину изменений оценивали по бальной системе.
Таблица 6
Изменения частоты сокращений сердца лягушки в зависимости от
модуляции СВЧ поля и исходной частоты сокращений сердца
|
Варианты опыта |
Количество сердец |
Частота |
Количество баллов (среднее по группам) |
Всего количество баллов |
||
|
Исходная частота биений сердца |
||||||
|
20–30 |
31–40 |
41–50 |
||||
|
I |
23 |
20, 22, 24, 25, 28, |
50 |
3 |
3 |
56 |
|
II |
28 |
30, 32, 34, 36, 38 |
11 |
12 |
9 |
32 |
|
III |
22 |
40, 42, 44, 46, 48 |
9 |
1 |
16 |
26 |
|
IV |
26 |
Непрерывный режим |
1 |
— |
— |
2 |
|
V |
30 |
«ложное» облучение |
— |
— |
— |
0 |
При каждом из трех режимов модуляции наибольшие изменения в ритмике сердца от исходного уровня были при условии совпадения их величин (табл.6). Наибольшие изменения были при воздействии ЭМП в режиме модуляции 20–28 Гц в группе сердец с частотой сокращений 20–30 ударов в 1 минуту.
Исследования In Vivo
Предполагалось, что роль модуляции в развитии биоэффектов должна быть более ярко выражена при исследовании реакции целостного организма. В этой связи, ряд исследований были проведены с использованием поведенческих реакций.
Было исследовано поведение крыс после воздействия ЭМП 915 МГц с частотной модуляцией 4, 6,16 и 20 Гц; время облучения 10 минут (Семенова Т. П. и др., 2000). При всех заданных частотах модуляции S=10 мВт/см2. Для воздействия использовали магнетронный генератор. Была группа животных с «ложным» облучением.
Непосредственно после облучения исследовали поведение животных в условиях действия на них ряда стресс-факторов: незнакомой обстановки, открытого пространства, высоты, яркого света. С этой целью проводили наблюдения за особенностями поведения в приподнятом крестообразном лабиринте, когда животные должны были совершать пробежки по узким лучам лабиринта на большой высоте над уровнем пола. Эта методика широко используется для оценки эмоционального поведения крыс, в частности выраженности у них уровня тревожности. Оценивали время «замирания».
Лабиринт состоял из двух открытых (40Í12 см) и двух закрытых (40Í12 см) рукавов, ограниченных непрозрачными стенками размером 40Í40 см. Входы в открытые рукава были расположены друг напротив друга на расстоянии 10 см. Лабиринт находился на высоте 90 см над уровнем пола. Все эксперименты проводили в утренние часы — с 9.00 до 12.00. В начале эксперимента животное помещали в центральную часть лабиринта и в течение 5 мин проводили наблюдение за его поведением. У животных регистрировали число заходов в открытые и закрытые лучи лабиринта, число переходов в лучах лабиринта и время реакции замирания. По окончании работы с животными протирали пол лабиринта и через 10–15 мин начинали работу со следующими животными.
В результате воздействия ЭМП, модулированного частотами 4 и 6 Гц, число заходов в открытые лучи лабиринта за 5 мин наблюдения возросло в 3.7 и в 4.5 раза соответственно по сравнению с контролем, что является показателем значительного понижения у животных уровня тревожности от пребывания в лабиринте (табл.7). При частоте модуляции 16 Гц изменения этого показателя были выражены слабее — число заходов было увеличено в 2.3 раза, а при 20 Гц его значение по существу не отличалось от контрольного.
Таблица 7.
Особенности поведения крыс в крестообразном лабиринте после воздействия МЭМП.
|
Частота |
Число крыс |
Число заходов в «открытые лучи» |
Число заходов в «закрытые лучи» |
Время замирания, сек |
|
Контроль 4 6 16 20 |
9 7 4 6 9 |
1.1±0.2 4.1±0.7** 5.0±0.6** 2.5±0.3* 1.0±0.1 |
6.8±0.6 8.7±1.2 9.7±1.7 7.0±1.9 4.0±0.7** |
24.0±4.0 5.7±1.8** 5.0±1.5** 1.8±0.9*** 50.4±8.9* |
Примечание. Отличие данных от контроля по t-критерию Стьюдента достоверны:
* — p<0.05; ** —p<0.01; *** — p<0.001
По показателю времени замирания, характеризующему степень выраженности у животного пассивно-оборонительного поведения, также было выявлено разнонаправленное влияние на него ЭМП, зависящее от частоты его модуляции. Под воздействием ЭМП с частотой модуляции 4, 6 и 16 Гц время замирания снижалось в 4.2, 4.8 и 13.3 раза соответственно. При повышении частоты модуляции до 20 Гц время замирания животных, наоборот, возрастало в 2.4 раза.
Двигательная активность животных, определяемая по числу заходов в закрытые лучи лабиринта, не претерпевало достоверных изменений после воздействия на них ЭМП, модулированного частотами 4, 6 и 16 Гц. Однако при частоте модуляции 20 Гц уровень этого показателя был снижен в 1,7 раза.
Таким образом, сравнительный анализ изменений под влиянием ЭМП показателей эмоционального поведения (таблица 7) выявил, что число заходов в открытые лучи лабиринта у крыс, подвергнутых воздействию ЭМП с частотами модуляции 4 и 6 Гц, возрастало до 373 и 450% соответственно по сравнению с контролем, условно принятым за 100% (p<0.01). На частоте модуляции 16 Гц этот показатель увеличился до 225% (p<0.05), а при частоте 20 Гц наблюдалась тенденция к его снижению.
Сравнительный анализ представленных в таблице данных характеризует изменения реакций замирания под воздействием низкоинтенсивного ЭМП при разных частотах модуляции. Показано, что при модуляции 4, 6 и 16 Гц у крыс значительно сокращается длительность реакции замирания на 76%, (p<0,01), на 79% и 93% (p<0,001) для соответствующих частот. В отличие от этого на частоте модуляции 20 Гц длительность реакции замирания крыс превышала контрольный уровень на 110% (p< 0.05).
Весьма серьезные реакции были зафиксированы в поведении крыс при воздействии МЭМП (Судаков К. В., Антимоний Г. Д., 1973, 1977; Антимоний Г. Д., 1974). Крыс облучали ЭМП 40 МГц, модуляция 50 Гц, глубина модуляции 80–100%, напряженность поля 100–120 В/м, длительность воздействия была от 5 минут до 2.5 часов. В этих экспериментах были зарегистрированы фазовые изменения поведенческих реакций вплоть до развития у части животных каталептического состояния.
Исследовали возможное влияние модулированных и немодулированных ЭМП на эпилептиформную активность крыс с потенциальным наличием аудиогенных судорог. (Коновалов В. Ф., Сериков Н. С., 2001). Животных облучали ЭМП 880 МГц, S=1мВт/см2 в течение 5 минут ежедневно в течение 5 суток. 40 крыс были разделены на 4 серии: I серия — непрерывное облучение (CW); II серия — модуляция 4 Гц; III серия — модуляция 16 Гц IV серия — «ложное» облучение. Наблюдения за животными продолжалось 1,5 года.
В результате воздействия МЭМП произошло подавление судорожного предрасположения у животных как при модуляции 4 Гц, так и 16 Гц. При непрерывном режиме воздействия этот эффект был выражен незначительно и он проявился только через 3 месяца после облучения (табл.8)
Таблица.8.
Проявление аудиогенных судорог у крыс (%) в четырех экспериментальных группах
после воздействия немодулированными и модулированными ЭМП
|
Время повторного тестирования после (провокация аудиогенных судорог). |
Группа животных |
|||
|
1 (CW) |
2 (4 Гц) |
3 (16 Гц) |
4 (ложное облучение) |
|
|
1 |
2 |
3 |
4 |
5 |
|
1 день |
100 |
20* |
20* |
100 |
|
1 неделя |
100 |
20* |
20* |
100 |
|
2 недели |
100 |
20* |
20* |
100 |
|
1 |
2 |
3 |
4 |
5 |
|
3 недели |
100 |
20* |
20* |
100 |
|
1 месяц |
100 |
20* |
20* |
100 |
|
2 месяца |
100 |
20* |
20* |
100 |
|
3 месяца |
80 |
60 |
80 |
100 |
|
4 месяца |
80 |
60 |
80 |
100 |
|
5 месяцев |
80 |
60 |
80 |
100 |
|
6 месяцев |
80 |
80 |
80 |
100 |
|
12 месяцев |
20* |
80 |
20* |
100 |
|
18 месяцев |
37,5 |
66,6 |
25 |
100 |
* статистически значимое различие по критерию Стюдента (p< 0,05)
Было изучено влияние модулированного ЭМП на механизм целенаправленного поведения животных (Судаков К. В., 1976, 1998). Опыты проводили на крысах, которых облучали ЭМП 30 МГц, частота модуляции 2, 7 и 50 Гц, глубина модуляции 80%, напряженность поля 30 В/м. Использовали генератор, конденсаторные пластины которого были укреплены вдоль стенок камеры. Продолжительность воздействия 10 минут.
Исследовали влияние МЭМП на реакцию самораздражения во время воздействия. В опыте был использовано 30 крыс. Раздражение переднего, латерального и заднего гипотамуса, медиальных и латеральных ядер перегородки производили электрическим током 10–12 В, длительность импульсов 0,1–0,5 мс. У всех животных вызывали реакцию самораздражения.
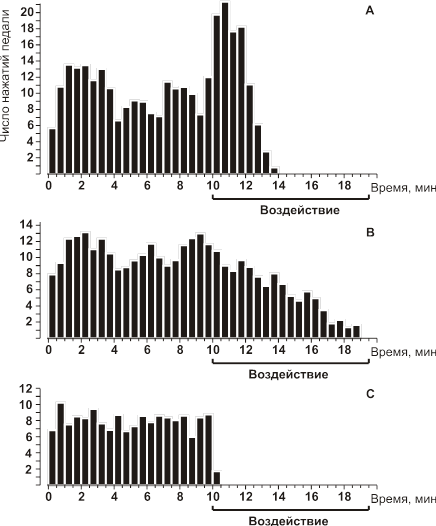
При действии ЭМП с частотой модуляции 2 Гц в течение первых 2-х мин наблюдалось увеличение частоты реакции самораздражения на 93%, затем частота реакции самораздражения резко снижалась и через 4 мин исчезала полностью (Рис. 14А). При действии МЭМП с частотой модуляции 7 Гц в первые 2 мин реакции самораздражения практически не отличалась от фоновой и только затем, в течение 12–15 мин, наблюдалось уменьшение ее частоты (Рис.14B). Иную картину наблюдалась при действии МЭМП с модуляцией 50 Гц — практически сразу от начала воздействия у всех животных реакция самораздражения блокировалась (Рис. 14C). Характерно, что указанные эффекты МЭМП не зависели от локализации кончиков раздражающих электродов (раздражающей области мозга).
Была изучена двигательная активность кроликов в условиях хронического импульсного облучения микроволнами низкой интенсивности, (Григорьев Ю. Г. и др., 1995).
|
Кроликов облучали электромагнитными полями 1,5 ГГц. Характер модуляции был импульсный, импульс прямоугольной формы, длительность импульса 16 мс, частота повторения импульса 0,12 Гц, S=300 мкВт/см2. Животных облучали ежедневно по 30 минут в течение месяца. Электромагнитное воздействие и «ложное облучение» производили в рандоминизированном порядке. Наблюдения за двигательной активностью кроликов проводили во время воздействия ежедневно 30 минут в течение 1 месяца. В период 30-ти минутного истинного или «ложного» облучения кроликов помещали в специально изготовленную из оргстекла клетку. Снаружи ко дну клетки был прикреплен пьезокристалл, позволяющий дифференцировать двигательные реакции. Графическая запись двигательных реакций и их обработка велась с помощью полиграфа и «Телевидео– 286» (США).
Только начиная с 14-х суток хронического воздействия, развились у животных достоверные дезадаптационные двигательные проявления в виде усиления беспокойства и тревоги.
Была изучена реакция отдельных нейронов головного мозга на низко интенсивное пачечно-импульсное СВЧ облучение. (Моисеева Н. В., 1996).
Опыты были проведены на кроликах. Воздействие ЭМП 1,5 ГГц, 100%-ная амплитудная модуляция, меандр, длительность импульса 0,4 мс, частота повторения 1000 Гц, длительность пачек 16 мс, с частотой их повторения 0,12 Гц, S=300 мкВт/см2. Воздействие проводили в звукоизолированной безэховой камере с коэффициентом отражения 30 дБ. Генератор СВЧ — Г3–21. Время облучения 1 минута. В качестве контроля использовалась группа животных с «ложным облучением». Исследования проводили до, во время и сразу после воздействия.
Эксперименты были проведены на 22 кроликах породы Шиншилла, масса 3 кг. Изучали биоэлектрическую активность 139 нейронов сенсоматорный и теменно-затылочной областей коры головного мозга. Импульсную активность записывали с помощью миниатюрного микроманипулятора с шагом винта 500 мкм. Погруженным микроэлектродом служил стеклянный капилляр с внутренним диаметром кончика 1–3 мкм, заполненный трехмолярным физиологическим раствором хлорида натрия (сопротивление 5–30 МОм). В качестве проводов использовали хлорвиниловые трубки с тем же раствором на основе агар-агара.
Анализировали частоту разрядов нейронов и их характер в период 3-минутной записи (1 мин — фон, 1 мин период облучения и 1 мин период последействия). Облучение и контроль проводились в рондомизированном порядке.
Под влиянием МЭМП достоверно изменилась активность нейронов, увеличилось число нейронов, изменивших свою частоту. Характер реакции нейронов зависел от исходной их активности (табл. 9–11). Нейроны, возбуждающиеся в период воздействия МЭМП, изменили свою реакцию на торможение в период последействия.
Таблица 9.
Характеристика реакций нейронов сенсомоторной области коры головного мозга кролика на низкоинтенсивное пачечно-импульсное СВЧ облучение
|
Характер |
Количество нейронов, % от общего количества |
Средняя частота |
||
|
До |
Во время |
После |
||
|
Возбуждение |
24.14* |
5.5±0.66 |
16.3±0.78 |
6.03±0.64 |
|
Торможение |
31.03* |
11.82±0.7 |
4.3±0.49 |
4.3±0.49 |
|
Не реагирует |
44.83* |
9.82±0.67 |
9.34±0.68 |
9.34±0.79 |
* p<0.01 относительно контроля (табл.18.3); ** p<0.01 относительно фона.
Таблица 10.
Характеристика реакций нейронов теменно-затылочной области коры головного мозга кролика на низкоинтенсивное пачечно-импульсное СВЧ облучение
|
Характер |
Количество нейронов, % от общего количества |
Средняя частота |
||
|
До |
Во время |
После |
||
|
Возбуждение |
23.23* |
5.52±0.4 |
11.25±0.76** |
2.83±0.47** |
|
Торможение |
30.47* |
9.67±0.73 |
3.58±0.68** |
4.45±0.61** |
|
Не реагирует |
46.3* |
6.13±0.52 |
5.9±0.47 |
5.33±0.42 |
Примечание. См. примечание к табл. 18.1; * p<0.01 относительно общего количества зарегистрированных нейронов; ** p<0.05 относительно исходного фона.
Таблица 11.
Характеристика реакций нейронов сенсомоторной и теменно-затылочной областей коры головного мозга кролика на ложное облучение (контрольная серия)
|
Области |
Характер реакций |
Количество нейронов, % от общего количества (63) |
Средняя частота |
||
|
До |
Во время ложного воздействия |
После |
|||
|
Сенсомоторная |
Возбуждение |
3.04 |
5.2±1.32 |
6.94±1.5 |
7.8±1.09 |
|
Торможение |
11.75 |
9.1±0.32 |
6.1±0.53 |
6.3±0.38 |
|
|
Не реагируют |
85.21 |
8.7±0.4 |
8.0±0.44 |
8.6±0.41 |
|
|
Теменно-затылочная (73 нейрона) |
Возбуждение |
5.65 |
2.26±2.2 |
4.1±1.6 |
8.4±2.15 |
|
Торможение |
10.3 |
5.47±0.44 |
3.2±0.52 |
3.93±0.45 |
|
|
Не реагируют |
84.05 |
6.2±0.42 |
5.8±0.38 |
6.5±0.39 |
Таким образом, при воздействии в течение 1 минуты ЭМП 1,5 ГГц, 300 мкВт/см2 при пачечно-импульсной модуляции было зарегистрировано изменение активности нейронов коры головного.
В повторных опыта было также изучено влияние модулированного ЭМП на импульсную биоэлектрическую активность нейронов коры головного мозга кролика с тем же видом модуляции, за исключением пачечно-импульсного воздействия. (Лукьянова С. Н., Моисеева Н. В., 1998).
Облучение животных проводили в безэховой камере, коэффициент отражения 30 дБ. ЭМП 1,5 ГГц, импульсная модуляция, длительность импульса 0,4 мс с частотой повторения 1000 Гц, S=30 мкВт/см2. Генератор Г3–21. Время воздействия 1 мин. Была серия с «ложным облучением».
Исследования проводили до, во время и после воздействия в течение 1 минуты. Эксперименты были проведены на 22 необездвиженных и ненаркотизированных кроликах-самцах породы Шиншилла весом 3 кг, мягко фиксиованных на деревянном станке. Изучали экстраклеточную биоэлектрическую активность нейронов сенсо-моторной и теменно-затылочной областей коры головного мозга. Записывали импульсную биоэлектрическую активность с помощью изготовленного из оргстекла миниатюрного микроманипулятора с шагом винта 500 мкм, который крепился на голове кролика и позволял регистрировать импульсную активность не только до и после, но и во время действия ЭМП. Погружным микроэлектродом служил стеклянный капилляр с внутренним диаметром кончика 1–3 мкм, заполненный трехмолярным раствором хлорида натрия (сопротивление 5÷30 МОм). Индеферентный электрод крепился на ухе кролика. В качестве проводов использовали хлорвиниловые трубки с физиологическим раствором на основе агар-агара. Анализировали частоту разрядов нейронов и их характер в период 3 мин записи (1мин — фон, 1 мин — период облучения и 1 мин — период последействия). Облучение и «ложное» облучение проводили в рондомизированном порядке. Статистически оценивали проявление реакции по частоте импульсации нейронной активности в период облучения относительно фона и соответствующего контроля исследований, используя критерий Стьюдента и χ2.
Количественная характеристика изменений в импульсной биоэлектрической активности сенсо-моторной и теменно-затылочной областей коры головного мозга в условиях проведенных экспериментов представлена в табл.12. Из таблицы следует, что облучение по сравнению с контролем, приводило к достоверно большему количеству нейронов, достоверно изменяющих свою частоту биоэлектрической активности относительно исходного фона. Среди реагирующих нейронов (от 55 до 60%) наблюдалось одинаковое количество клеток как с реакцией увеличения частоты импульсации, так и уменьшения.
Таблица 12.
Сравнительная характеристика процента реакций нейронов сенсо-моторной и теменно-затылочной областей коры головного мозга кролика
в экспериментах с облучением МЭМП
|
Серия |
Область |
Число записанных нейронов |
% нейронов (от общего количества) |
||
|
Достоверно изменяющих свою импульсацию в виде: |
Не реагирующих |
||||
|
Увеличения |
Уменьшения |
||||
|
МЭМП |
Сенсорно-моторная |
105 |
27.62* |
2.38* |
40.0* |
|
Теменно-затылочная |
84 |
25.0* |
29.76* |
45.24* |
|
|
“Ложное” воздействие |
Сенсорно-моторная |
72 |
2.7 |
11.1 |
86.2 |
|
Теменно-затылочная |
73 |
5.48 |
10.96 |
83.56 |
* p<0.01 относительно контроля, по критерию χ2.
В табл. 13 и 14 представлены характеристики частоты импульсации нейронов в контроле и с облучением МЭМП. Как следует из табл. 13, достоверные изменения в контроле частоты импульсации нейронов практически отсутствовали. В период МЭМП облучения могло иметь место достоверное как снижение, так и увеличение частоты импульсации (табл. 14).
Таблица 13.
Характеристика частоты импульсации нейронов сенсо-моторной и теменно — затылочной областей коры головного мозга кролика в экспериментах с “ложным” облучением
|
Область коры головного мозга |
Характер |
Средняя частота, Гц |
||
|
До воздействия |
Во время действия |
После действия |
||
|
Сенсорно-моторная |
Возбуждение Торможение Не реагируют |
5.2±1.32 9.1±0.62 8.7±0.4 |
6.94±1.5 6.1±0.83 8.0±0.44 |
7.8±1.09 6.3±0.98* 8.6±0.41 |
|
Теменно-затылочная |
Возбуждение Торможение Не реагируют |
2.26±1.5 5.47±0.94 6.2±0.42 |
4.1±1.6 3.2±0.92 5.8±0.38 |
8.4±1.9 3.93±0.85 6.5±0.39 |
Примечание. Количественная характеристика реакций представлена в табл.19.1.
*p<0.05 относительно исходного фона по критерию Стьюдента.
В первую минуту после воздействия МЭМП в случае активации биоэлектрической активности отмечалась тенденция возвращения к фоновым величинам, а в случае торможения биоэлектрическая активность достоверно не отличалась от исходного фона. Следует отметить, что характер изменения импульсации нейронов на воздействие модулированного ЭМП был связан с исходным фоном. В фоне имела место тенденция к большей частоте импульсации в случае урежения по сравнению с учащением разрядов нейронов под влиянием МЭМП. По мнению авторов, происходило корригирующее влияние МЭМП.
Таблица 14.
Характеристика реакций нейронов сенсо-моторной и теменно-затылочной областей коры головного мозга кролика на облучение МЭМП
|
Область коры головного мозга |
Характер реакции |
Средняя частота, Гц |
||
|
До воздействия |
Во время действия |
После действия |
||
|
Сенсорно-моторная (105 нейрона) |
Увеличение Уменьшение Отсутствие |
6.1±0.89*** 8.92±0.88 6.9±0.54 |
11.2±0.64* 4.32±0.7* 7.5±0.69 |
9.2±0.58*,** 8.85±0.69** 7.1±0.85 |
|
Теменно-заты-лочная (84 нейрона) |
Увеличение Уменьшение Отсутствие |
4.92±0.45*** 6.53±0.39 5.4±0.83 |
8.4±0.53* 4.13±0.57* 6.38±0.71 |
6.9±0.48*,** 6.89±0.75** 6.05±0.66 |
* p<0.05 относительно исходного фона по критерию Стьюдента.
** p<0.05 относительно периода действия по критерию Стьюдента.
***p<0.05 при сравнении фоновых значений импульсации нейронов с тормозным характером реакций.
Вышеизложенное находит свое отражение и в гистограммах распределения частоты импульсации нейронов в экспериментах с МЭМП (рис.15 и 16). Из рис.15 видно, что частота импульсации возбуждающихся нейронов достоверно увеличивается и сохраняется на протяжении всего периода облучения МЭМП. В период же последействия биоэлектрическая импульсная активность снижалась, хотя и оставалась выше фоновой. Рассматривая реакцию нейронов, снижающих свою импульсацию на воздействие МЭМП (рис. 16), было отмечено, что частота импульсации достоверно снижалась в период облучения МЭМП и восстанавливалась до средних фоновых значений в период «последействия». Во время действия МЭМП наблюдалась пачечно-групповое раздражение нейронов, которое в период «последействия» менялась на регулярное. Из приведенных гистограмм следует, что характер раздражения нейронов был различным и зависел от исходного фона.
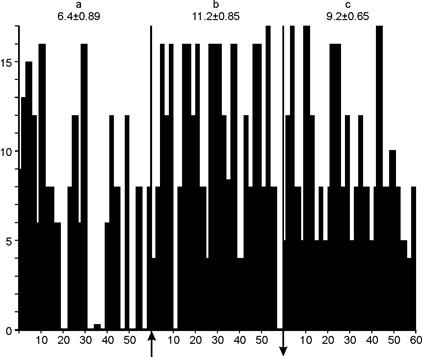
Рис. 15. Гистограмма распределения частоты импульсации нейронов, возбуждающихся в ответ на одноминутное облучение МЭМП.
А — фон, b — период облучения, c — после облучения. По оси абсцисс — время, с;
по оси ординат — частота импульсации, имп/с (Гц).
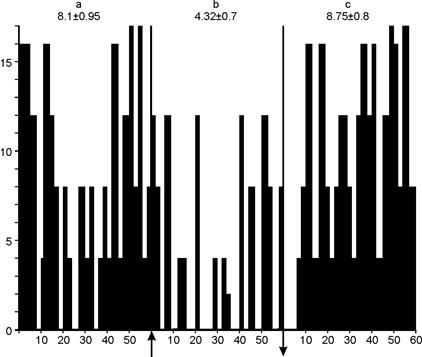
Рис. 16. Гистограмма распределения частоты импульсации нейронов, тормозящихся в ответ на одноминутное облучение МЭМП.
А — фон, b — период облучения, c — после облучения. По оси абсцисс — время, с; по оси ординат — частота импульсации нейронов, имп/с (Гц)
Таким образом, было установлено наличие реакции экстраклеточной биоэлектрической активности нейронов на низкоинтенсивные МЭМП. Характер реакции определялся фоном, свидетельствуя о корригирующем влиянии МЭМП.
Несколько исследований было посвящено исследованию влияния модулированного ЭМП на биоэлектрическую активность мозга животных. Конечно, данная экспериментальная модель не позволяет количественно точно оценить характер изменений, однако выявить определенную тенденцию влияния модулированного ЭМП на спектр биоэлектрической активности мозга является возможным.
Было исследовано влияние ЭМП 980 МГц, импульсно модулированного 12 и 27 Гц, S=30–50 мВт/см2 на биоэлектрическую активность мозга (Иванова В. Ю. и др., 2000), Эксперимент проводили на кошках. Регистрацию ЭЭГ осуществляли угольными электродами в области вертекса. Время однократного воздействия 20 мин.
Во время повторных воздействий МЭМП было зарегистрировано увеличение спектральной мощности спектра биотоков в диапазоне 12–18 Гц.
В другом эксперименте было изучено влияние на суммарную биоэлектрическую активность различных структур головного мозга модулированных низкоинтенсивных ЭМП (Григорьев Ю. Г. и др., 1995). Было проведено четыре серии экспериментов:
1. ложное облучение — К;
2. серия с импульсным облучением частотой 0.12 Гц (О1);
3. серия с импульсным облучением частотой 1000 Гц (О2);
4. серия с пачечно-импульсными облучением; частота повторения импульсов — 1000 Гц, частота повторения пачек — 0.12 Гц (О3).
Во всех случаях ППЭ в импульсе было 300 мкВт/см2. Одному кролику предъявили только один режим облучения однократно в течение 30 мин. Однако каждый из животных в случайном порядке участвовал в контрольной серии с ложным облучением. Детальная количественная характеристика экспериментов и параметры облучения представлены в табл.15 и 16.
Таблица 15.
Количественная характеристика экспериментов
|
Серия |
Число кроликов |
Количество 30-мин |
|
|
Номер |
Условное обозначение |
В серии |
В серии |
|
1 2 |
К О1 |
30 10 |
— 10 |
|
3 |
О2 |
10 |
10 |
|
4 |
О3 |
10 |
10 |
Каждому кролику были вживлены электроды по общепринятому методу, согласно координатам, представленным в стереотактическом атласе Е. Фифковой и Дж. Маршала. Были исследованы области коры и следующие подкорковые образования: базальное ядро амигдалы (АВ: АP-1, SD-5, V-16), гиппокамп (HiP: AP-5, SD-5, V-5), септум (NSL: AP-4, SD-1, V-3), передний отдел гипоталамуса (AHA: Ap-2.5, SD-1.5, V-12), головка хвостатого ядра (ПС: AP-4.2, SD-2.8, V-8.6). В кору и гиппокам в большинстве случаев электроды вживляли слева и справа, остальные — справа.
В качестве электродов и отводящих проводов использовали хлорвиниловые пипетки и трубки, заполненные физиологическим раствором на основе агар-агара в консистенции геля. Они имели сопротивление 1 МОм и удовлетворяли требованиям, предъявляемым к проводникам биопотенциалов. Отведение биотоков осуществляли монополярным способом с индифферентными электродами на носовых костях. В период эксперимента кролика мягко фиксировали за лапы на деревянном станке. Эксперименты проводили в условиях удовлетворяющих требованиям к проведению электрофизиологических опытов с МЭМП.
Таблица 16.
Параметры облучения МЭМП
|
№ |
Условное обозначение Серии |
Параметры облучения |
Время облучения, Мин. |
||||||
|
Несущая Частота, Гц |
Режим |
Характеристика |
|||||||
|
Импульсов |
Пачек |
||||||||
|
S, мкВт\см2 |
Длительность, |
Частота, Гц |
Длительность, Мс |
Частота, Гц |
|||||
|
2 |
О1 |
1.5 |
Импульсный |
300 |
16 |
0.12 |
30 |
||
|
3 |
О2 |
1.5 |
Импульсный |
300 |
0.4 |
1000 |
30 |
||
|
4 |
О3 |
1.5 |
Пачечно-импульсный |
300 |
0.4 |
1000 |
16 |
0.12 |
30 |
В результате проведенного эксперимента были получены достоверные изменения биоэлектрической активности структур головного мозга при всех трех режимах воздействия, примерно, в равной степени. Это не позволило авторам разделить условия воздействия по их эффективности. Во всех трех сериях изменения определялись исходным фоном, однако они не выходили за пределы нормального функционирования и касались, главным образом, θ-диапазонов гиппокампа. Достоверное различие между контролем и облучение было отмечено только в биотоках гиппокампов.
Был поставлен эксперимент с целью выяснения механизмов подавления соматовегетативных реакций модулированным ЭМП (Каштанов С. Н., Судаков С. К., 1981). Эксперимент был поставлен на кроликах. Животных облучали ЭМП 40 МГц с модуляцией 7 Гц, напряженность поля от 30 до 300 В/м. Длительность воздействия была от 10 мин до 2½ часов.
На первом этапе был получен эффект подавления соматовегетативных реакций, вызванных раздражением вентральных ядер гипоталамуса. На втором этапе исследования проводили поочередную коагуляцию отдельных структур мозга и в результате было установлено, что ретикулярная формация участвует в реализации вегетативных ответных реакций при воздействии МЭМП.
Были исследованы реакции в различных отделах нервной системы при воздействии модулированного ЭМП в условиях эмоционального стресса (гистохимические исследования) (Горбунова А. В. и др., 1981).
В опытах были использованы кролики в состоянии эмоционального стресса. Животных облучали ЭМП 39 МГц, модуляция 7 Гц, глубина модуляции 80%, напряженность поля 30 В/м. Поле создавали между двумя пластинами конденсатора, соединенным с генератором УВЧ. Иммобилизированных животных размещали между пластинами, сагетальная линия тела располагалась горизонтально и перпендикулярно силовым линиям МЭМП. Время облучения 3 часа. Исследования проводили сразу после облучения.
Опыты проведены на 86 кроликах. Эмоциональный стресс вызывали раздражением электрическим током гипоталамуса, кожи конечностей и ушей. В узловатом ганглии блуждающего нерва, верхнем шейном, звездчатом ганглиях, симпатических узлах и узлах симпатической цепочки на уровне 4–6-го грудных сегментов определяли содержание водорастворимых белков. Спектр изоферментов лактатдегидрогеназы (ЛДГ) исследовали в узлах автономной нервной системы и проводящей системе сердца.
МЭМП избирательно активировало лимбические структуры мозга и подавляло восходящее влияние ретикулярной формации на кору больших полушарий, повышая устойчивость животных к эмоциональному стрессу и увеличивая их способность к адаптации.
Для оценки роли модуляции при воздействии МЭМП была использована хорошо разработанная в общей физиологии методика импринтинга (Григорьев Ю. Г., 1996). Импринтинг — это своеобразный вид памяти: при рождении организм фиксирует в своей памяти, то, что он впервые увидел.
129 эмбрионов цыплят облучали на 16-й день инкубации ЭМП 9.3 ГГц с импульсной модуляцией 10 и 40 Гц, меандр, длительность импульса 2,5 мс, время воздействия 5 мин, S=40 мкВт/см2.Кроме того были серии с непрерывным облучением (CW) и «ложным» воздействием.
Подавление импринтинга до 50%, выявленное у родившихся цыплят, было только в серии с модулированным воздействием ЭМП 10 и 40 Гц (табл.17). В условиях CW воздействия (S=40 мкВт/см2) и в контроле нарушение импринтинга не было отмечено.
Таблица 17.
Формирование импринтинга у цыплят после облучения эмбрионов ЭМП
в непрерывном и модулированном режимах.
|
Серии |
Название серии |
ППЭ, |
Время Облучения |
Число Эмбрионов |
Число |
|
1. |
Контроль ложное облучение |
— |
— |
83 |
81 (97%) |
|
2. |
Непрерывное облучение |
40 |
5 |
27 |
23 (89%) |
|
3. |
Модулированное облучение 10 Гц или |
40 |
5 |
19 |
9 (50%) |
В одном из экспериментов была поставлена задача исследовать возможность фиксации головным мозгом определенного режима модуляции ЭМП (Григорьев Ю. Г., 1996). В этом эксперименте была также использована модель импринтинга, а в качестве импринт-стимула был использован сигнал импульсной модуляции ЭМП. Облучение цыплят осуществляли на 16-й день инкубации в безэховой камере: ЭМП 9,3 ГГц с импульсной модуляцией 1, 2, 3, 7, 9 или 10 Гц, S=0.04 мВт/см2, время каждого облучения 5 минут.
Ранее была показана возможность выработка временных связей у 15 дневных куриных эмбрионов при помощи электротока и звука (Hunt,1949). Учитывая это, авторы эксперимента предположили, что электромагнитный модулированный сигнал может быть зафиксирован мозгом и приобрести значение импринт-сигнала. Схема эксперимента была следующей: на 16-й день инкубации эмбрионы были облучены МЭМП с модуляцией 1, 2, 3, 7, 9 и 10 Гц. После рождения цыплят чувствительный период к импринтированию (24 часа после рождения) был пропущен и в этот период никаких внешних раздражителей цыпленку не предъявлялось. Через 48 часов после рождения цыпленку предъявляли как бы импринт-стимул в виде мигающего света с той же частотой, с которой эмбрион был подвергнут электромагнитному облучению на 16-й день инкубации. Различие между предполагаемым световым импринт-стимулом и дифференцировочным стимулом было равно 8 Гц.
Опыты были проведены на 127 эмбрионах (цыплятах). Возможность проявления импринтинга на импринт-стимул с частотой мелькания света, аналогичной модуляции ЭМП, с которой облучали эмбрионы на 16-й день инкубации, при частоте мелькания 1, 2, 3, 7, 9 или 10 Гц представлена на рисунке 17. Анализ полученных материалов позволил автору сделать вывод, что полученные данные свидетельствуют о том, что головной мозг эмбрионов на 16-е сутки инкубации может зафиксировать электромагнитный стимул с модуляцией 9 или 10 Гц и сохранить эту информацию в течение определенного времени после рождения. Таким образом: получены данные позволяющие предположить, что режим модуляции ЭМП может фиксироваться головным мозгом.
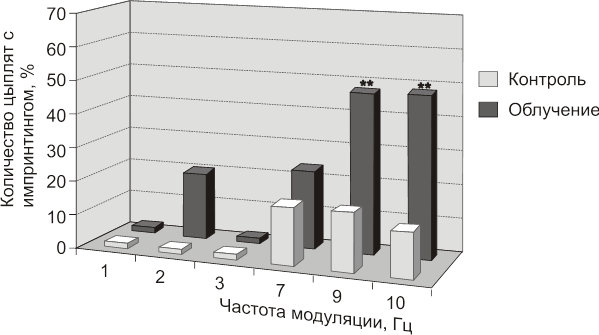
Рис.17. Число цыплят, головной мозг которых зафиксировал электромагнитный модулированный сигнал (был установлен импринтинг).
Были использованы эмбрионы дрозофил для оценки биологического действия модулированного ЭМП (Большаков М. А. и др. 2001, Большаков М. А., 2002). Эмбрионов облучали МЭМП, 460 МГц, импульсная модуляция 2.5, 6, 10, 16, 22 и 40 Гц (скважность 25), средняя УПМ (SAR) 0.12 Вт/кг, поглощенная мощность за импульс 3 Вт/кг. Величина импульсной УПМ была одинакова при скважности от 12.5 до 6 на частоте модуляции 16 Гц. Эмбрионов облучали при температуре +24.5°С. Время воздействия 5 минут. Контрольные группы: «ложное» облучение и физический контроль.
Время развития эмбрионов (возраст) отсчитывали от начала кладки яиц мухами на питательную среду с точностью до 10 минут. В эксперименте использовали эмбрионы в возрасте 15 часов 10 минут. Опыты были поставлены на 30 тысяч эмбрионах, объем выборок составлял не менее 1000 на каждую экспериментальную точку.
Результаты экспериментов оценивали по величине процента прерванного развития (ППР), рассчитывающегося как процент не вылетевших имаго из соответствующих кладок яиц, количество которых принималось за 100%. ППР учитывали в трех экспериментальных группах: 1) опытная группа, в которой эмбрионов подвергали облучению МЭМП; 2) «ложно облученная» группа, в которой эмбрионов подвергали тем же экспериментальным процедурам, что и облученных эмбрионов, но без воздействия ЭМП (доставка к месту облучения, помещение на 5 мин в термостатируемые условия облучатель без включения генератора ЭМП, возвращение в термостат для инкубации); 3) контрольная группа эмбрионов, все время находившихся в термостатируемых условиях (24.5°С), по которым оценивалось текущее функциональное состояние лабораторной популяции мух.
В результате проведения эксперимента было показано, что облучение МЭМП оказывало влияние на эмбрионы дрозофилы в возрасте 15 час 10 мин. Этот эффект зависел от частоты модуляции (Рис.18 и 19). Важно отметить, что различие в SAR модулированного (0.12 Вт/кг) и немодулированного (6 Вт/кг) излучения отличались почти в 50 раз.
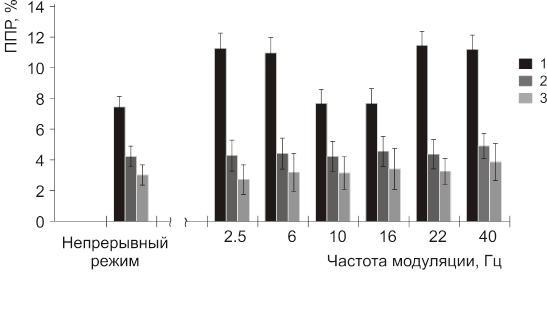
Рис.18. Влияние МЭМП 460 МГц на ППР дрозофил (представлены средние значения и ошибки, средних с уровнем значимости <0.05). Для сравнения приведены результаты 5-ти минутного немодулированного воздействия с SAR 6 Вт/кг. 1 — ППР после облучения МЭМП; 2 — ППР «ложно облученные»; 3 — ППР в лабораторном контроле.
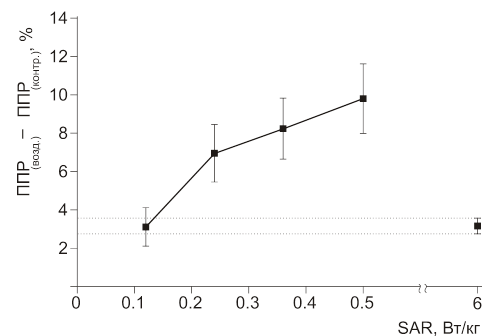
Рис. 19. Зависимость величены эффекта облучения МЭМП эмбрионов дрозофил с частотой 16 Гц (средняя SAR менялась в зависимости от скважности — от 25 до 6). Для сравнения представлены среднее значение эффекта немодулированного ЭМП с SAR 6 Вт/кг и ошибка среднего (пунктирные линии).
Было исследовано влияние модулированного ЭМП на эмбрионы дрозофил на фоне повышения температуры окружающей среды (Большаков М. А. и др., 2002). Опыты были поставлены на 15 тыс. эмбрионах, которых подвергали немодулированному ЭМП с SAR 6 Вт/кг (в импульсе и средняя — 0.12 Вт/кг) и модулированному электромагнитному воздействию 6, 10, 16, 22 Гц, SAR 3 Вт/кг. Во всех сериях, включая контроль, температура окружающей среды была 40°С. Для всех режимов воздействия выборка была не менее 1000 эмбрионов для каждой из групп.
Результаты воздействия оценивали по величине процента прерванного развития (ППР). Величина ППР рассчитывали как процент невылетевших имаго из соответствующих кладок яиц, количество которых принималось за 100%. ППР оценивался в четырех различных группах: 1) непрерывное облучение эмбрионов, 2) эмбрионы, облученные МЭМП; 3) «ложно» облученные эмбрионы, которых подвергали воздействию только повышенной температурой без ЭМП и 4) контрольные эмбрионы, которые постоянно содержались в термостатируемых условиях при фиксированной температуре 24.5°С. Эффект воздействия определялся как разность между ППР групп, подвергнутых непрерывному ЭМП, модулированному ЭМП и «ложно» облученных групп.
Сочетанное действие немодулированного ЭМП с УПМ 6 Вт/кг и нагрева до 40°С приводило к незначительному увеличению ППР, эффект оказался статистически незначимым по сравнению с эффектом при нормальной температуре 24.5°С 3.8±1.1% в условиях нагрева против 3.2±0,7% при нормальной температуре. Эффект воздействия только повышенной температурой — 40°С на эмбрионы составил 1.3±0,7%.
Результаты исследования влияния МЭМП на фоне нагрева представлены на рисунке 20. Как видно из этого рисунка, эффект существенно зависел от частоты импульсной модуляции. МЭПМ с частотами модуляции 6 и 22 Гц на фоне нагрева незначительно увеличивало ППР, по сравнению с ППР при нормальной температуре. Напротив, при частотах модуляции 10 и 16 Гц воздействие на фоне повышенной температуры инициировало меньший ППР (p<0,05), нежели при нормальной температуре (рисунок 20). Величина ППР при условии повышенной температуры была на уровне ППР «ложно» облученных эмбрионов.
Таким образом, эффекты нагрева и воздействия импульсной модуляции ЭМП 6 и 22 Гц аддитивны. При частотах 10 и 16 Гц биоэффект уменьшался.

Рис. 20. Изменение процента прерванного развития у дрозофил после 5-минутного воздействия на эмбрионы возраста 15 ч 10 мин МЭМП при нормальной температуре 25°С (1) и на фоне повышенной температуры 40°С (2). Заштрихованное пространство — 95%-й доверительный интервал для средних значений ППР «ложно» облученных эмбрионов.
Было изучено влияние модулированных низкоинтенсивных ЭМП на развитие и жизнеспособность клеща (Буренков М. С. и др., 1996). Опыты ставились на яйцах, голодных личинках, сытых личинках и голодных нимфах первого лабораторного поколения клеща.
Облучения МЭМП проводили через 5—10 суток после окончания яйцекладки или после насыщения клещей и перехода их в следующую фазу развития. Использовали следующие режимы воздействия: R1(К) — «ложное» облучение; R2 — широкополосное излучение в диапазоне 1–4 ГГц, импульсная модуляция 7 Гц, длительность импульса 20 мс, средняя S=20 мкВт/см2; R3 — несущая 3 ГГц, пачечно-импульсная модуляция, частота импульсов 1 кГц, частота следования пачек 7 Гц, длительность пачки импульсов 20 мс, средняя S=10 мкВт/см2; R4 — то же, что и R3, но при средней S=20 мкВт/см2; R5 — широкополосное излучение в диапазоне 1–4 ГГц импульсная модуляция 2 Гц, длительность импульса 20 мс, средняя S=30 мкВт/см2; R6 — несущая 1 ГГц, импульсная модуляция 2 Гц, длительность импульса 20 мс, средняя S=30 мкВт/см2. Исследования проводили сразу после облучения и в течение всего цикла развития.
Клещей содержали при комнатной температуре (22–23°С) в увлажненных камерах. Каждый опыт состоял из 2–4 повторных вариантов, а отдельный вариант включал или одну полную яйцекладку или 10 особей личинок и нимф.
Были получены следующие основные результаты.
1. Влияние МЭМП облучения яйцеклеток на отрождение голодных личинок. Общее количество отродившихся личинок было одинаково во всех сериях. Различия были обнаружены в ходе и сроках их отрождения, а также в динамике последующей активности. Задержка отрождения наблюдалась во всех опытных вариантах. В контроле 50% личинок вылупилось из яиц на 12-е сутки, а в опыте — на 15–32-е сутки (табл.18). Наименьшая задержка в развитии была отмечена в режиме R2. Разница между опытом и контролем в этом случае составила 3.4 суток (p<0.09). Отрождение 50% личинок в режимах R3 и R4 длилось соответственно 25.3 и 32.2 суток. Отличия от контроля были статистически достоверны (p<0.01) и разница между контролем и опытом достигла соответственно 13.4 и 20.3 сут. Сходные тенденции проявлялись и в динамике активности отродившихся личинок. Особи, вылупившиеся из интактных и облученных в режимах R2 яйцекладок, становились активными в первый же день после отрождения, в то время как в режимах R3 и R4 активация задерживалась на продолжительное время –T50 составляло (p<0.0001) между интактыми и облученными яйцекладками (режимы R3 и R4) и столь же существенные отличия были варианта R2 от вариантов R3 и R4.
2. Влияние МЭМП на выживаемость голодных личинок и нимф. Облучение МЭМП голодных личинок и нимф было проведено на 7–10-е сутки после вылупления. Длительность выживания личинок и нимф во всех вариантах опытов было ниже, чем в контроле. Так, показатель T50 для личинок и нимф в контроле составил соответственно 13.8 ± 1.9 и 36.9±2.0 (табл.18), то в опыте (режимы R4 и R5) он был на 2–4 и 9–10 сутки меньше (9.5–11.9 и 27.1–28.2).
Таблица 18.
Влияние МЭМП на отрождение, активацию и длительность выживания голодных нимф различных фаз развития клеща Hyalomma asiaticum
|
Режим |
Число особей |
Число групп |
Коэффициент пробит-регрессии |
T50, сут |
Длительность отрождения личинок
|
R1(K) |
3000 |
2 |
0.24±0.002 |
11.9±1.0 |
|
R2 |
3000 |
2 |
0.25±0.01 |
15.3±0.1 |
|
R3 |
3000 |
2 |
0.08±0.01 |
25.3±0.1 |
|
R4 |
3000 |
2 |
0.07±0.01 |
32.2±0.7 |
Длительность активации отродившихся личинок
|
R1(K) |
3000 |
2 |
— |
1.0 |
|
R2 |
3000 |
2 |
— |
1.0 |
|
R3 |
3000 |
2 |
0.08±0.01 |
17.03±0.4 |
|
R4 |
3000 |
2 |
0.07±0.01 |
23.9±0.5 |
Длительность выживания голодных личинок
|
R1(K) |
20 |
2 |
0.14±0.01 |
13.8±1.9 |
|
R4 |
20 |
2 |
0.14±0.01 |
11.9±1.0 |
|
R5 |
20 |
2 |
0.14±0.01 |
9.5±4.0 |
Длительность выживания голодных нимф
|
R1(K) |
150 |
15 |
0.05±0.01 |
36.9±2.0 |
|
R4 |
150 |
15 |
0.05±0.01 |
27.1±2.7 |
|
R5 |
250 |
20 |
0.05±0.01 |
28.2±20 |
3. Влияние МЭМП на развитие сытых личинок. Опыт был проведен на клещах весенней и осенней генерации. Облучение сытых личинок проводили на 10-е сутки после насыщения клещей. Использовали режимы R3, R4, R5 и R6. Первые отродившиеся нимфы появились в одинаковые сроки после облучения, как в весенней, так и в осенней генерации — на 16–18-е сутки после насыщения личинок; опытные и контрольные варианты не различались. По другим показателям наблюдались существенные расхождения. Линька как облученных, так и интактных клещей весенней генерации протекала в значительно более короткие сроки, чем осенней. Период линьки в первой серии опытов занимал от 2 до 5 сутки, тогда как во второй — 8–12 сутки. Наибольшие расхождения отмечены в количестве отродившихся нимф. Сытые личинки весенней генерации оказались менее чувствительными ко всем режимам ЭМП. Во всех вариантах наблюдалось 100%-е превращение личинок в нимф. Последующая выживаемость отродившихся голодных особей не отличалась от контрольных значений и была близка к 100% в течение 16–25 последующих суток.
Таким образом, ЭМП практически во всех исследуемых режимах вызывало заметные физиологические изменения в организме клеща. Эти изменения выражались в задержке отрождения личинок из облученных яйцекладок, в снижении активности и выживаемости отродившихся особей. Сходные проявления наблюдались и в ходе отрождения голодных нимф из облученных личинок. Увеличение средней ППЭ с 10 до 20 мкВт/см2 усиливало наблюдаемый эффект. Так, длительность отрождения и активации 50% личинок увеличивалось на 30–35%, а выживаемость голодных нимф осенней генерации, напротив, снижалось вдвое.
Использование в опытах широкополосные излучения в диапазоне 1–4 ГГц (R2 и R5) с частотами модуляции 7 и 2 Гц вызывали в целом сходные, но существенно менее выраженные эффекты, чем на несущих частотах 3 и 1 ГГц с той же модуляцией. Наиболее выраженное биологическое действие излучения, выражавшееся в угнетении развития и увеличении смертности клеща, на разных фазах его жизненного цикла, было выявлено при воздействии 3 ГГц с частотой модуляции 7 Гц. Особенно острые нарушения в протекании физиологических процессов имели место в ходе эмбрионального развития и метаморфоза.
Заключение
Анализ результатов 28 отечественных экспериментов проведенных in vitro, in situ, in vivo с использованием модулированных электромагнитных полей РЧ позволяет сделать следующие основные выводы:
· при воздействии на биосистемы ЭМП с менее или более сложными режимами модуляции возможно развитие биоэффектов как физиологических, так и неблагоприятных, отличных от биоэффектов, вызванных немодулированными ЭМП;
· острое воздействие модулированных ЭМП низких интенсивностей (нетепловые уровни) может привести к развитию патологических эффектов;
· имеется зависимость развития ответной биологической реакции по своей интенсивности и направленности от конкретного режима модуляции ЭМП; эта зависимость установлена на всех уровнях биологических систем – in vitro, in situ и in vivo.
· как правило, модулированные ЭМП вызывают более выраженные биоэффекты, чем непрерывный режим модуляции.
· влияние модуляции ЭМП РЧ более выражено при более низких уровнях интенсивности.
Полученные данные указывают на возможность влияния модуляции ЭМП на развитие биологического эффекта на уровне сложных системных взаимодействий в организме. Это позволяет выделить модулированное ЭМП в особую группу излучений, биологический эффект которых зависит не только от величены поглощенной энергии, но и от формы модуляции, “адресованной” к той или иной функционирующей системе. Это определяет вывод, что при оценке опасности модулированных ЭМП важна не только величина поглощенной энергии, но и сам факт контакта человека с этим видом излучения. Это обстоятельство вносит большую неопределенность при разработке стандартов ЭМП.
Существенно важны индивидуальные особенности человека, его индивидуальная чувствительность к определенному режиму модуляции ЭМП, что расширяет проблему гиперчувствительности к ЭМП.
В результате проведенных экспериментов с МЭМП выявлено влияние исходного состояния биосистемы на ожидаемый эффект. Данный факт весьма важен, т. к. не позволяет установить общую закономерность в развитии биоэффектов при определенных видах модуляции. Фактически исходный фон системы организма может определять характер и направленность ответной реакции, что усложняет прогноз ожидаемых эффектов в условиях воздействия МЭМП на население.
Роль модуляции приобретает большую значимость при низкой интенсивности (при нетепловых уровнях ЭМП). В этой связи именно этот фактор становится в настоящее время определяющим при оценке воздействия ЭМП РЧ на население.
Экспериментальное подтверждение зависимости развития биоэффекта от вида модуляции указывает на вовлечение новых механизмов взаимодействия организма с МЭМП, которые не ясны и требуют своего изучения.