Известно, что одновременно с нейрофизиологическими и морфологическими механизмами формирования болевого ощущения и активации антиноцицептивной системы важную роль играют пептидергические механизмы, включающие эндогенные опиоидные пептиды (ОпП), СТ-, ДА — и НА-ергические системы.
Опиоидергические механизмы.
Изначально ОпП считались экзогенными факторами, вызывающими аналгезию (Pert, 1973; Hiller et al., 1978; Zukin, 1981; Cesselin et al., 1984; Iadorola et al., 1985; Millan et al., 1986; Stein et al., 1989; Levine, Taiwo, 1989; Herz, 1989; Viel, 1991). Способность ОпП вызывать местный аналгетический эффект при их аппликации на ткани была описана еще в XVIII веке. Так, английский врач Н. Хеберден в 1774 году опубликовал работу, в которой описал положительный эффект аппликации экстракта опия при лечении геморроидальных болей (Krajnik et al., 1999). Однако выяснилось, что эти пептиды в дозах меньших, чем аналгетические, могут давать ряд эффектов, которые позволяют в настоящее время считать их регуляторами и модуляторами многих процессов (Вальдман, 1984; Раевский, 1982; Miller, 1981), а аналгетический эффект рассматривать как одно из проявлений модуляторной функции (Todd, 2000; Bie, 2003). ОпП и опиоидные рецепторы (ОпР) широко распространены в ЦНС (Тигранян, 1984; Мiller, 1981; Могилевский, 1987; Dickenson, 1996).
По характеру химического строения ОпП делят на 2 класса: энкефалины, содержащие 5-8 аминокислотных остатков, и эндорфины, содержащие 16 таких остатков и более. Эндорфины обладают более высокой и длительной опиатной активностью, чем энкефалины; предполагается, что это определяется, во-первых, тем, что энкефалины имеют более короткую цепочку аминокислот и поэтому более интенсивно разрушаются соответствующими ферментами, и, во-вторых, тем, что эндорфины по своей третичной структуре ближе к морфину.
Выделяют пять типов ОпР: m (mu), k (kappa), s (sigma), d (delta), e (epsilon). Дополнительно среди отдельных типов различают подтипы: m1, m2, k1, k2 (Benedetti, 1990). Основные сведения о физиологических эффектах, зарегистрированных при активации различных типов ОпР приведены в табл. 2.1.
Таблица 2.1.
Физиологические эффекты при активации опиоидных рецепторов (по M. L. Buck, J. J. Blumer (1991) с изменениями)
| Эффекты | Опиоидные рецепторы | ||||
| M 1 | M 2 | K | S | D | |
| Аналгезия | + | — | + | — | ? |
| Седация | — | + | + | — | ? |
| Дисфория | — | — | — | + | — |
| Тошнота, рвота | + | — | — | — | + |
| Изменение температуры тела | + | — | — | — | — |
| Угнетение дыхания | — | + | +/- | — | + |
| Стимуляция дыхания | — | — | — | + | — |
| Брадикардия | — | + | — | — | — |
| Запор | + | -(?) | — | — | — |
| Задержка выведения мочи | + | — | — | — | — |
| Стимуляция диуреза | — | — | + | — | — |
| Зуд кожи | + | — | — | — | + |
| Толерантность/зависимость | + | +(?) |
Примечание: “+” – наличие эффекта; “-” – отсутствие эффекта; “+/-” – частичный эффект; ?–— данные отсутствуют.
В зависимости от взаимодействия различных препаратов с ОпР их делят на четыре группы: полные агонисты, частичные агонисты, агонист-антагонисты, полные антагонисты (табл. 2.2; рис. 2.6).
Таблица 2.2.
Классификация препаратов в зависимости от взаимодействия с различными типами опиоидных рецепторов (по M. L. Buck, J. J. Blumer (1991) изменениями)
| Препараты | Взаимодействие с опиоидными рецепторами | ||
| M | K | S | |
| Полные агонисты | |||
| — морфин | Агонист | Агонист | — |
| — меперидин | Агонист | Агонист | — |
| — метадон | Агонист | Агонист | — |
| — гидроморфон | Агонист | Агонист | — |
| — фентанил | Агонист | Агонист | — |
| — альфентанил | Агонист | Агонист | — |
| — суфентанил | Агонист | Агонист | — |
| — оксиморфон | Агонист | Агонист | — |
| — альфапродин | Агонист | Агонист | — |
| — леворфанол | Агонист | Агонист | — |
| Частичные агонисты | |||
| — бупренорфин | Частичный агонист | — | — |
| — дезоцин | Частичный агонист | — | — |
| Агонист—антагонисты | |||
| — налорфин | Антагонист | Агонист | Агонист |
| — пентазоцин | Антагонист | Агонист | Агонист |
| — буторфанол | Антагонист | Агонист | Агонист |
| — налбуфин | Антагонист | Агонист | Агонист |
| Полные антагонисты | |||
| — налоксон | Антагонист | Антагонист | Антагонист |
| — налтрексон | Антагонист | Антагонист | Антагонист |
| — налмефен | Антагонист | Антагонист | Антагонист |
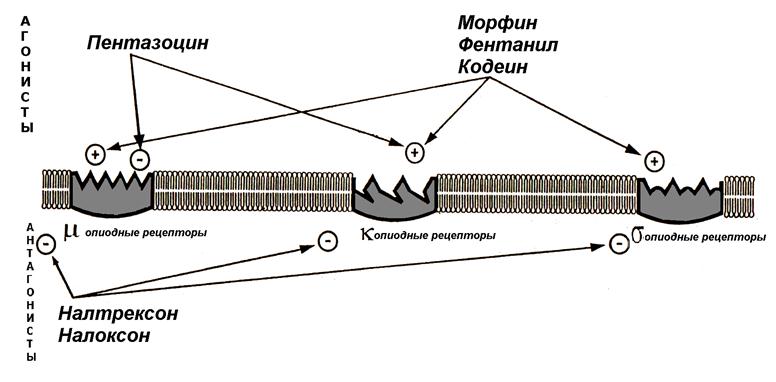
Рис. 2.6. Схема взаимодействия разных видов опиоидных рецепторов с агонистами-антагонистами.
Отмечено, что ОпР локализуются в тех областях мозга, которые имеют непосредственное отношение к формированию болевой чувствительности, эмоционально-вегетативных реакций, аффективных состояний и подавлению болевых ощущений (Kachaturian et al., 1985; Viel, 1991; Nerenius, 1992; Herz et al., 1993; Mansour et al., 1995; Martin-Schild et al., 1999; Kozicz et al., 2002; Millan, 2003). Так, областями, богатыми местами связывания ОпП, являются лимбическая система, желатинозная субстанция, задние рога спинного мозга, большое ядро шва, средний таламус, околоводопроводное и перивевтрикулярное серое вещество. Кроме того, ОпР обнаружены и вне ЦНС – в периферических нервах (Hassan et al., 1993), на иммунных клетках (Przewlocki et al., 1992; Lawrence et al., 1992), в хромаффинных клетках надпочечников (Тигранян, 1984), кишечнике (Мiller, 1981, Polar, 1977).
ОпП, обладают широким спектром биологического действия. Выполняя в организме функции нейромодуляторов, нейромедиаторов и гормонов (Harmar, 1987; Гомазков, 1991; Раевский, 1982, Millan, 2003), они влияют на многие системы организма, включая нейромедиаторную (North, 1983), нейроэндокринную (Кареева, 1985; Armstrong, 1990), иммунную (Carr, 1991), влияют на эмоциональное и психическое состояние организма (Simon, 1991), характеризуются противовоспалительным (Stein, 1991, 1995; Khasar et al., 1995), антистрессорным действием (Вальдман, 1988; Лишманов, 1997). Так, показана дезинтеграция эндогенной опиоидной системы, а именно изменение регионального и тканевого распределения ОпП при возникновении стресса (Пшеникова, 1986; Вальдман, 1988; Панченко, 1999), физических нагрузках (Storzo, 1989), а также некоторых формах патологии: гипертонии (Kraft, 1991), ожирении (Naggert, 1995), алкоголизме (Буров, 1985), наркомании (Gudehithlu, 1991), шизофрении (Watson, 1979), эпилепсии (Bajorek, 1986), болезни Альцгеймера (Simon, 1991) и других неврологических и психических расстройствах ЦНС. Например, у особей, предрасположенных к развитию алкоголизма и наркомании, отмечается дефицит ОпП и одновременное увеличение содержания нейропептидов, индуцирующих страх, агрессию и дисфорию (Буров, 1985, Gudehithlu, 1991). Напротив, при стрессе уровень опиоидов в крови, спинномозговой жидкости, структурах ЦНС и других тканях увеличивается (Herz, 1989).
При болевом стрессе происходит образование и выделение ОпП в разных отделах мозга, растет их содержание в крови. Это сопровождается такими защитными явлениями, как повышение болевого порога и развитие аналгезии (Beluzzi, 1976; Jia, 1977), изменение поведения (Ami, 1978), гипертермия (Мillan, 1981; Blasig, 1978) и др., причем указанные явления предупреждаются блокаторами ОпР или ингибиторами синтеза пептидов.
Изменение концентрации ОпП при болевом стрессе подтверждается экспериментальными исследованиями. Так, R. I. Мillan и соавт. (1981) подвергали крыс 5-минутному электроболевому воздействию на конечности и установили, что сразу после такого воздействия в 10 раз возрастает уровень β-эндорфинов. Рост уровня эндорфинов в крови, сохраняющийся более 1 ч после стрессорного воздействия, сопровождается существенным (на 20–40%) снижением содержания иммунореактнвных β-эндорфинов в передней и промежуточной долях гипофиза, а также в гипоталамусе и ткани перивентрикулярной зоны. Причем ряд явлений, возникающих при стрессе, может быть воспроизведен путем экзогенного введения природных ОпП или их синтетических аналогов (Булаев, 1982; Ашмарин, 1984).
Механизм и локализация действия ОпП как регуляторов и модуляторов физиологических процессов определяются тем, что они взаимодействуют на уровне клетки со множеством других регуляторных факторов. Это взаимодействие еще изучено мало, но к настоящему времени с определенной долей вероятности можно полагать, что оно реализуется либо путем влияния на характеристики возбудимых мембран и тем самым на реакцию клеток-эффекторов на приходящие к ним нервные и гуморальные стимулы, либо путем воздействия на высвобождение и рецепцию медиаторов (Dismures, 1979; Вальдман, 1984).
В настоящее время имеются данные, свидетельствующие о том, что ОпП могут существенно ограничивать активацию симпатической нервной системы путем угнетения через ОпР высвобождения НА из симпатических терминалей (Henderson, 1976; Belle, 1979; Millan, 2003). Кроме того, предполагается, что ОпП тормозят взаимодействие нейронов и других клеток с НА путем инактивации аденилатциклазы в постсинаптической мембране (Joseph, 1981; Koski, 1981; Stiles, 1981). Иными словами, функция ОпП, по-видимому, направлена на сохранение гомеостаза организма.
Серотонинергическая система.
СТ (5-гидрокситриптамин) – биогенный амин с выраженными вазоконстрикторными свойствами – был открыт, идентифицирован и назван M. Rapport и I. Page (Eide and Hole, 1993; Silberstein, 1998). У человека 90 % СТ содержится в энтерохромаффинных клетках слизистой оболочки желудочно-кишечного тракта, остальной СТ находится в тромбоцитах и ЦНС (Lance, 1967; Fozard, 1982).
СТ-ергическая нейрональная система представлена многочисленными нейронами ядер центрального серого вещества, шва ствола и среднего мозга и широкой сетью аксонов, проецирующихся в различные структуры головного и спинного мозга. Эти структуры ЦНС традиционно рассматриваются как одно из главных звеньев эндогенной болеутоляющей системы. Впервые предположение о связи между болевым синдромом и нарушением обмена эндогенного СТ было высказано в конце 50-х годов H. Wolff (1995). В других исследованиях также показано, что изменение уровня СТ в ЦНС приводит к изменению функций эндогенной СТ-ергической антиноцицептивной системы и центральной регуляции болевой чувствительности (Lance, 1967; 1988; Abad et al., 1989; Seltzer et al., 1989; Ardid, Guilbaud, 1992; Lang et al., 1996; Esser, Sawynok, 1999; Sawynok et al., 1999; Wang et al., 1999; Vogel, 2003; Millan, 2003). Известно, что СТ-ергические нейроны шва среднего мозга иннервируют церебральные сосуды, а их активность влияет на интенсивность мозгового кровотока (Lance, 1967; Martin, 1994).
Известно, что СТ-ергические механизмы контролируют формирование множества поведенческих и эмоциональных проявлений (Azmitia, 1978; Spoont, 1992; Millan, 2003), играют заметную роль в пищевом, половом, исследовательском поведении, участвуют в формировании аффективных компонентов поведенческих актов, определяют становление и поддержание суточных и циркадианных ритмов физиологических процессов, осуществляют температурную регуляцию организма (Silberstein, 1998; Гилинский и др., 2004).
Катехоламинергическая система.
НА и ДА – одни из важнейших нейромедиаторов в ЦНС, модулирующие острые и хронические болевые реакции (Raja, 1995; Maldonado, 1997; Haws et al., 1990; Nuseir et al., 1999). НА-ергические структуры мозга сосредоточены в латеральном отделе ствола и промежуточного мозга, особенно ими богата ретикулярная формация (Scheibner et al., 2001; Bucheler et al., 2002; Ihalainen, Tanila, 2002). Часть их аксонов идет к коре, а другая — к другим образованиям мозга (Овсянников, 1990; Брагин, 1991). Также НА широко представлен вне ЦНС (табл. 2.3.) Эффекты КА осуществляются путем связывания со специфическими для них рецепторами.
Таблица 2.3.
Физиологичекие эффекты различных типов адренорецепторов (по Я. В. Благосклонной и соавт., 2004)
| Органы и ткани | Адренорецептор (тип) | Эффект |
| Сердце (миокард) | B1 | Увеличивает силу сокращения |
| B2 | Увеличивает частоту сокращений сердца | |
| Кровеносные сосуды | A | Вазоконстрикция |
| B2 | Вазодилатация | |
| Почки | B | Увеличивает секрецию ренина |
| Панкреас | A | Уменьшает секрецию инсулина и глюкагона |
| B | Увеличивает секрецию инсулина и глюкагона | |
| Печень | A, b | Увеличивает глюкогенолиз |
| Жировая ткань | B (1,2,3) | Увеличивает липолиз |
| Метаболизм в тканях | B | Увеличивает калоригенез |
| Кожа (потовые железы) | A | Увеличивает потоотделение |
| Бронхи и бронхиолы | B2 | Стимулирует дилатацию |
| Матка | A | Увеличивает сократимость |
| B2 | Релаксация | |
| Кишечник и мочевой пузырь | A, b | Увеличивает релаксацию и усиливает сокращения сфинктеров |
Ядра ретикулярной формации ствола и моста мозга являются источником нескольких восходящиx КА-ергических путей (Lindvall, Bjorklund, 1984; Aston-Jones et al., 1991; Valentino, Aston-Jones, 1995; Schatzberg, Schildkraut, 1995; Tanaka et al., 2000). Наиболее мощные из них — вентральный и дорсальный восходящие НА-ергические пути.
В исследованиях Е. О. Брагина (1991) показано, что периферическая катехоламиновая система подавляет, а центральная активирует механизмы антиноцицепции. Однако наблюдения и экспериментальные исследования других авторов свидетельствуют о том, что активация центральных адренергических механизмов эфедрином вызывает аналгезию у оперированных и неоперированных крыс с подавлением эмоционально-поведенческих и гиподинамических проявлений боли (Ярош, 1990). Причем адренергические механизмы супрасегментарного уровня регулируют гиподинамические реакции с участием α2-рецепторов, а сегментарно-поведенческие проявления реализуются через α1-адренорецепторы. При сильном болевом воздействии активизируются отрицательные эмоциональные зоны гипоталамуса и возбуждается адренергический механизм, что приводит к блокаде болевой импульсации с последующим вовлечением и опиоидного механизма (Bjorklund et al., 1999; Hein, 2001; Schramm et al., 2001). Также показано, что НА — тормозит проведение ноцицептивных импульсов на сегментарном и стволовом уровнях (Yaksh et al., 1984; Millan, 2003).
Необходимо отметить, что КА, активно функционирующие при болевом возбуждении, играют и определенную роль в процессах памяти, что позволяет организму фиксировать накопленный опыт избегания и защиты от вредоносных факторов. Так, блокада НА приводила к исчезновению навыка избегания ноцицептивного электрокожного раздражения (Громова, 1980), а введение крысам гидроксидофамина, вызывающего уменьшение содержания КА в гипоталамусе, стриатуме и переднем мозге, вызывало исчезновение активного избегания ноцицептивного стимула с сохранением пассивного (Smith et al., 1975).
ДА-ергическая система также принимает участие в регуляции боли (Калюжный, 1987; Брагин, 1991; Millan, 2003). Показано, что уменьшение аналгезии при стрессе наблюдается при блокаде ДА-вых рецепторов галоперидолом, а активация ДА-ергической системы усиливает морфиновую анестезию (Васильев, 1985; Овсянников, 1990; Брагин, 1991).
ГАМК-ергическая система.
В настоящее время весьма актуально дальнейшее изучение роли ГАМК-ергических механизмов в повышении устойчивости организма к боли (Михайлович, Игнатов, 1990; Nestler, Aghajanian, 1997; Nestler, 2001; Williams et al., 2001; Watts, 2002; Chao, Nestler, 2004). Однако исследования подобного плана немногочисленны и противоречивы, что обусловливает необходимость изучения ГАМК-ергических процессов как факторов нейромедиаторной и метаболической адаптации к ноцицептивному воздействию различного генеза. Аналгетический эффект, возникающий при активации разных типов ГАМК-рецепторов, имеет относительно независимые механизмы реализации, чем и объясняется отсутствие перекрестной толерантности к болеутоляющему влиянию ГАМК агонистов (Bonci, Williams, 1997; Ingram et al., 1998; Jolas et al., 2000).
Формирование ГАМК-ергической аналгезии зависит также от функциональной активности адренергической, СТ-ергической и холинергической систем. Так, например, аналгетический эффект реализуется с участием опиоидергическиx механизмов. Развитие толерантности к болеутоляющему действию ГАМК-агонистов и ингибиторов ГАМК-трансаминазы опосредуется через α1-адренергические и СТ-ергические рецепторы (Jolas et al., 2000; Chao, Nestler, 2004). Установлено, что важнейшим механизмом аналгетического эффекта ГАМК-позитивных препаратов в условиях острого и хронического ноцицептивного воздействия является их активирующее влияние на эндогенные аналгетические системы (Nestler, Aghajanian, 1997; Jolas et al., 2000; Nestler, 2001; Williams et al., 2001; Chao, Nestler, 2004; Bihua Et Al., 2005).
Следовательно, многочисленными исследованиями показана совокупность влияний антиноцицептивных механизмов: опиоидного, СТ — и КА-ергического, что, по-видимому, не является простым суммированием их отдельных эффектов, а сложной их интеграцией на различных уровнях ЦНС (Брагин, 1991; Jones, 2003; Porro, 2003; Gebhart, 2004; Keltner et al., 2006; Ducreux et al., 2006). Причем, взаимодействие этих компонентов может быть как синергичным, так и антагонистичным. Так, установлена связь ОпП с ДА — и СТ-ергической системами, свидетельствующая о модулирующем действии этих пептидов на секрецию, метаболизм и эффекты ДА и СТ (Garcia-Sevilla, 1980). Показано, что ОпП могут блокировать ДА-вую нейропередачу при ее активации. Этот механизм блокируется частично налоксоном и тетродотоксином. Следовательно, можно полагать, что тормозное влияние ОпП на дофаминовую нейропередачу реализуется как прямо, через пресинаптические ОпР на терминалях ДА-ергических нейронов, так и опосредованно, через другие нейроны. Также установлено, что ОпП вызывают налоксонзависимое увеличение образования и высвобождение СТ из СТ-ергических нейронов (Garcia-Sevilla, 1980). Кроме того, аналгетическое действие ОпП в значительной мере реализуется с помощью СТ-ергической системы и зависит от метаболизма СТ (Lee, 1979; Маркевич, 1982). Так, например, усиление активности системы ОпП может увеличивать аналгезирующие эффекты СТ-ергического механизма, а снижение активности – их уменьшать.
Таким образом, в механизмах антиноцицепции большое значение принадлежит Оп-, СТ-, ДА-, НА — и ГАМК-ергическим системам. Причем более сложные взаимосвязи, по-видимому, имеются между Оп-, СТ — и КА-выми антиноцицептивными механизмами, так как действие последнего на болевую чувствительность может быть разнонаправленным. Вероятно, именно этой закономерностью объясняются противоречивые результаты экспериментов различных авторов при исследовании влияния КА на болевую чувствительность и аналгезию, вызванную морфином и СТ. Кроме того, при введении адренолитиков следует учитывать, что они в первую очередь воздействуют на эмоциональные компоненты болевой реакции организма, поэтому использование в качестве тестов болевой чувствительности таких критериев, как вокализация, кусание электродов и т. д., не адекватно, так как они отражают именно эмоциональные компоненты ноцицепции (Marinelli, Piazza, 2002).
Таким образом, можно заключить, что имеется постоянное взаимодействие ноцицептивной и антиноцицептивных систем организма, что, в конечном счете, формирует порог болевой чувствительности и его функциональные колебания. Антиноцицептивная система оказывает постоянное тоническое тормозное влияние на ноцицептивную, а порог болевой чувствительности определяется как уровнем активности ноцицептивной системы, так и антиноцицептивной. В свою очередь тоническое тормозное влияние антиноцицептивной системы на порог болевой чувствительности определяется интегративным взаимодействием многих, в том числе опиоидного, СТ- и адренергического антиноцицептивных механизмов, что, по-видимому, обусловлено функциональным состоянием различных физиологических систем организма.
Автор — Джелдубаева Эльвиза Рашидовна